Thi Online Trắc nghiệm Hóa học 10 Bài 11: Liên kết cộng hóa trị có đáp án
Trắc nghiệm Hóa học 10 Bài 11: Liên kết cộng hóa trị có đáp án
-
928 lượt thi
-
15 câu hỏi
-
30 phút
Câu 1:
Liên kết cộng hóa trị là liên kết được hình thành bởi
Đáp án đúng là: B
Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
Câu 2:
Liên kết giữa nguyên tử H và F trong phân tử HF được tạo nên bởi
Đáp án đúng là: A
Nguyên tử H có cấu hình electron là 1s1; nguyên tử Cl có cấu hình electron là 1s22s22p5. Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và F cùng góp 1 electron để tạo nên 1 cặp electron chung.
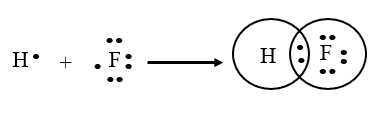
Công thức cấu tạo của HF là: H – F.
Câu 3:
Công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng gọi là
Đáp án đúng là: C
Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng.
Câu 4:
Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn
Đáp án đúng là: D
Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn bằng một nối đơn (–) và gọi là liên kết đơn.
Nếu giữa hai nguyên tử có hai cặp electron chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
Nếu giữa hai nguyên tử có ba cặp electron chung thì ba cặp electron này được biểu diễn bằng một nối ba () và gọi là liên kết ba.
Câu 5:
Công thức cấu tạo của CO2 là
Đáp án đúng là: C
Cấu hình electron nguyên tử của C (Z = 6): 1s22s22p2.
Cấu hình electron của nguyên tử O (Z = 8): 1s22s22p4.
Nguyên tử C cần thêm 4 electron để đạt được cấu hình bền vững của khí hiếm gần nhất; nguyên tử O cần 2 electron để đạt được cấu hình của khí hiếm gần nhất.
Mỗi nguyên tử O góp chung 2 electron, nguyên tử C góp chung 4 electron chia đều cho 2 nguyên tử O.
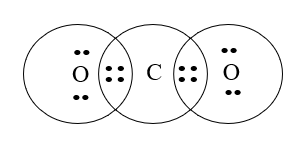
Công thức cấu tạo của CO2 là O=C=O.
Các bài thi hot trong chương:
( 1.1 K lượt thi )
( 0.9 K lượt thi )
( 852 lượt thi )
Đánh giá trung bình
0%
0%
0%
0%
0%
