Thi Online Trắc nghiệm Hóa học 10 Bài 14. Tính biến thiên enthalpy của phản ứng hóa học có đáp án
Trắc nghiệm Hóa học 10 Bài 14. Tính biến thiên enthalpy của phản ứng hóa học có đáp án
-
1529 lượt thi
-
15 câu hỏi
-
30 phút
Câu 1:
Sự phá vỡ liên kết cần ….. năng lượng, sự hình thành liên kết …... năng lượng.
Cụm từ tích hợp điền vào chỗ chấm trên lần lượt là
Đáp án đúng là: A
Sự phá vỡ liên kết cần cung cấp năng lượng, sự hình thành liên kết giải phóng năng lượng.
Câu 2:
Cho phản ứng có dạng: aA (g) + bB (g) ⟶ mM (g) + nN (g)
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết Eb là
Đáp án đúng là: B
Cho phản ứng có dạng: aA (g) + bB (g) ⟶ mM (g) + nN (g)
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết là:
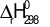 =
= 
Trong đó, Eb(A), Eb(B), Eb(M), Eb(N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong các phân tử A, B, M và N.
Câu 3:
Số lượng mỗi loại liên kết trong phân tử CH3Cl là
Đáp án đúng là: D
Công thức cấu tạo của CH3Cl là:
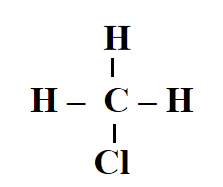
Vậy trong 1 phân tử CH3Cl có 3 liên kết C – H, 1 liên kết C – Cl.
Câu 4:
Cho phản ứng sau ở điều kiện chuẩn:
2H2 (g) + O2 (g)  2H2O (g)
2H2O (g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
Đáp án đúng là: A
2H – H (g) + O = O (g)  2H – O – H (g)
2H – O – H (g)
Biến thiên enthalpy chuẩn của phản ứng là
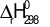 =
= 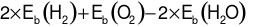
= 
= 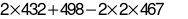
= − 506 (kJ)
Câu 5:
Cho phản ứng:
4HCl (g) + O2 (g)  2Cl2 (g) + 2 H2O (g)
2Cl2 (g) + 2 H2O (g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là bao nhiêu? Phản ứng tỏa nhiệt hay thu nhiệt?
Đáp án đúng là: A
4H − Cl (g) + O = O (g)  2Cl – Cl (g) + 2H – O – H (g)
2Cl – Cl (g) + 2H – O – H (g)
Biến thiên enthalpy chuẩn của phản ứng là
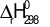 =
= 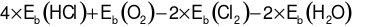
= 
= 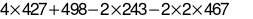
= − 148 (kJ)
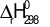 = − 148 kJ < 0 nên phản ứng tỏa nhiệt.
= − 148 kJ < 0 nên phản ứng tỏa nhiệt.
</>
Các bài thi hot trong chương:
Đánh giá trung bình
100%
0%
0%
0%
0%

Nhận xét
1 năm trước
Nguyễn Thị Phương