38 Đề thi chính thức vào 10 môn Hóa cực hay có lời giải chi tiết (Đề số 25)
21 người thi tuần này 5.0 62.7 K lượt thi 11 câu hỏi
- Đề số 1
- Đề số 2
- Đề số 3
- Đề số 4
- Đề số 5
- Đề số 6
- Đề số 7
- Đề số 8
- Đề số 9
- Đề số 10
- Đề số 11
- Đề số 12
- Đề số 13
- Đề số 14
- Đề số 15
- Đề số 16
- Đề số 17
- Đề số 18
- Đề số 19
- Đề số 20
- Đề số 21
- Đề số 22
- Đề số 23
- Đề số 24
- Đề số 25
- Đề số 26
- Đề số 27
- Đề số 28
- Đề số 29
- Đề số 30
- Đề số 31
- Đề số 32
- Đề số 33
- Đề số 34
- Đề số 35
- Đề số 36
- Đề số 37
- Đề số 38
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 29)
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 28)
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 27)
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 26)
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 25)
Trắc nghiệm tổng hợp Hóa 9 Chương 2: Các loại hợp chất vô cơ có đáp án - Đề 8
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 24)
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 23)
Danh sách câu hỏi:
Lời giải
a) Màu xanh của dung dịch CuSO4 nhạt dần kim loại màu đỏ bám trên đinh sắt:
Fe + CuSO4 → FeSO4 + Cu
b) Có khí không màu thoát ra, có kết tủa keo trắng sau đó kết tủa tan:
K + H2O → KOH + ½ H2
6KOH + Al2(SO4)3 → 2Al(OH)3 + 3Na2SO4
KOH + Al(OH)3 → KAlO2 + 2H2O
c) Chất rắn tan ra, dung dịch có màu vàng nâu và có khí không màu mùi hắc thoát ra:
2FeS2 + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
Lời giải
– Dùng dung dịch HCl cho vào các mẫu thử trên, nếu:
+ Tan tạo dung dịch trong suốt là Al2O3.
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Tan và có khí không màu thoát ra là Al4C3.
Al4C3 + 12HCl → 4AlCl3 + 3CH4
+ Tan và có khí màu vàng lục thoát ra là MnO2.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
+ Tan tạo dung dịch màu xanh là CuO.
CuO + 2HCl → CuCl2 + H2O
+ Tan và tạo kết tủa trắng là Ag2O.
Ag2O + 2HCl → 2AgCl + H2O
Lời giải
– Số mol KMnO4 = 0,2 (mol); số mol KOH = 2 (mol)
– Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,2 0,5
* Ở điều kiện nhiệt độ thường:
Cl2 + 2KOH → KCl + KClO + H2O
0,5 1,0 0,5 0,5
– Dư 1,0 mol KOH
CM (KCl) = CM (KClO) = 0,5 (M); CM (KOH dư) = 1 (M)
* Ở điều kiện đun nóng trên 700C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,5 1,0 5/6 1/6
– Dư 1,0 mol KOH
CM (KCl) = 5/6 (M); CM (KClO3) = 1/6 (M); CM (KOH dư) = 1 (M).
Lời giải
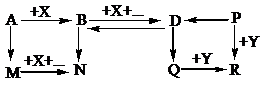
– Xác định các chất:
A là NaOH; B là Na2CO3; D là NaHCO3; M là NaAlO2; N là Al(OH)3;
P là Ba(HCO3)2; R là BaSO4; Q là BaCO3; Y là NaHSO4; X là CO2
– Các phương trình phản ứng:
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + CO2 + H2O →2NaHCO3
2NaHCO3 →Na2CO3 + CO2 + H2O
NaOH + Al + H2O → NaAlO2 + 3/2H2
NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3
3Na2CO3 + 2AlCl3 + 3H2O →6NaCl + 3CO2 + Al(OH)3
2NaHCO3 + Ba(OH)2 → Na2CO3 + BaCO3 + 2H2O
BaCO3 + 2NaHSO4 →BaSO4 + CO2 + Na2SO4 + H2O
Ba(HCO3)2 + 2NaHSO4 →BaSO4 + 2CO2 + Na2SO4 + 2H2O
Ba(HCO3)2 + Na2SO4 →BaSO4 + 2NaHCO3
Lời giải
– Gọi số mol các chất trong 15,15 gam hỗn hợp E lần lượt là a, b, c, d.
– Các phản ứng xảy ra:
Ca + 2H2O →Ca(OH)2 + H2
CaC2 + 2H2O →Ca(OH)2 + C2H2
Al4C3 + 12H2O →4Al(OH)3 + 3CH4
Ca(OH)2 + 2Al + 2H2O →Ca(AlO2)2 + 3H2
Ca(OH)2 + 2Al(OH)3 →Ca(AlO2)2 + 4H2O
– Áp dụng BTNT hidro: 2nH2O(đốt cháy) = 2nH2 + 2nC2H2 + 4nCH4
2b + 12c + 2d + 3a = 0,525.2 = 1,05
2(b + d) + 3(4c + a) = 1,05 = 2nCa + 3nAl
– Xét hỗn hợp X gồm: Al, Ca, C mX = mCa + mAl + mC = 15,15 (g)
mCa + mAl = 12,75 (g) nCa = 0,15 (mol) ; nAl = 0,25 (mol)
– Sản phẩm không có kết tủa nên dung dịch gồm: Ca(AlO2)2 và Ca(OH)2
– Bảo toàn nguyên tố Ca và Al dung dịch Y có 0,125 (mol) Ca(AlO2)2 ;
0,15 – 0,125 = 0,025 (mol) Ca(OH)2 và 0,4 (mol) HCl
Ca(OH)2 + 2HCl →CaCl2 + 2H2O
Ca(AlO2)2 + 2HCl + 2H2O →2Al(OH)3 + CaCl2
3HCl + Al(OH)3 →AlCl3 + 3H2O
– Áp dụng công thức tính nhanh: nHCl = 2nCa(OH)2 + 8nCa(AlO2)2 – 3n
0,4 = 0,025.2 + 8.0,125 – 3n
m1= 78.(0,65 : 3) = 16,9 (g)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.