Bộ 6 Đề kiểm tra Giữa kì 2 Hóa 11 có đáp án (Mới nhất) - Đề số 4
39 người thi tuần này 4.6 3.2 K lượt thi 30 câu hỏi 45 phút
🔥 Đề thi HOT:
15 câu Trắc nghiệm Hóa học 11 Kết nối tri thức Bài 15: Alkane có đáp án
15 câu Trắc nghiệm Hóa 11 Kết nối tri thức Bài 20: Alcohol có đáp án
37 câu Trắc nghiệm Hóa 11 Cánh diều Chủ đề 5: Dẫn xuất Halogen - Alcohol - Phenol
15 câu Trắc nghiệm Hóa 11 Kết nối tri thức Bài 19: Dẫn xuất halogen có đáp án
15 câu Trắc nghiệm Hóa học 11 Kết nối tri thức Bài 16: Hydrocarbon không no có đáp án
30 câu Trắc nghiệm Hóa 11 Cánh diều Bài 18: Hợp chất carbonyl có đáp án
15 câu Trắc nghiệm Hóa 11 Kết nối tri thức Bài 21: Phenol có đáp án
30 câu Trắc nghiệm Hóa 11 Cánh diều Bài 16. Alcohol có đáp án
Nội dung liên quan:
Danh sách câu hỏi:
Lời giải
Đáp án A
Phản ứng trùng hợp buta-1,3-đien được ứng dụng để điều chế cao su buna.
Phương trình hóa học:
n CH2 = CH – CH = CH2 (– CH2 – CH = CH – CH2 –)n
Câu 2
Cho các chất sau: metan, axetilen, etilen, pent-1-in và but-2-in. Số chất tác dụng được với dung dịch AgNO3/NH3 tạo kết tủa là
Lời giải
Đáp án D
Chất tác dụng với dung dịch AgNO3/NH3 tạo kết tủa có dạng ank-1-in.
⇒ Các chất thỏa mãn: axetilen, pent-1-in.
Câu 3
Đốt cháy hoàn toàn ankin X thu được 3,36 lít CO2 (đktc) và 1,8 gam H2O. Số mol ankin phản ứng là
Lời giải
Đáp án D
Ta có: \({n_{C{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15\,mol\); \({n_{{H_2}O}} = \frac{{1,8}}{{18}} = 0,1\,mol\)
⇒ \({n_{hh\,\,ankin}} = {n_{C{O_2}}} - {n_{{H_2}O}}\)= 0,15 – 0,1 = 0,05 mol
Lời giải
Đáp án A
Trong phòng thí nghiệm, etilen được điều chế bằng cách đun C2H5OH với H2SO4 đặc ở 170oC.
Phương trình hóa học:
C2H5OH CH2 = CH2 + H2
Câu 5
Cho các chất sau: C2H6 (a), C5H12 (b), C4H10 (c), C3H8 (d). Dãy các chất sắp xếp theo nhiệt độ sôi tăng dần là
Cho các chất sau: C2H6 (a), C5H12 (b), C4H10 (c), C3H8 (d). Dãy các chất sắp xếp theo nhiệt độ sôi tăng dần là
Lời giải
Đáp án C
Nhiệt độ sôi của các ankan tăng dần theo chiều tăng của phân tử khối.
⇒ Nhiệt độ sôi tăng dần từ (a), (d), (c), (b).
Lời giải
Đáp án B
Để phân biệt hai khí metan và etilen thì thuốc thử thích hợp là dung dịch nước brom. Etilen làm mất màu nước brom còn metan thì không.
CH2 = CH2 + Br2 ⟶ CH2Br – CH2Br
Câu 7
Biết rằng 0,1 lít khí etilen (đktc) làm mất màu tối đa 50 ml dung dịch nước brom. Nếu dùng 0,1 lít khí axetilen (đktc) thì có thể làm mất màu tối đa bao nhiêu ml dung dịch nước brom trên?
Lời giải
Đáp án D
Ta có: 1 phân tử etilen sẽ phản ứng với 1 phân tử brom.
Nhưng 1 phân tử axetilen sẽ phản ứng được với 2 phân tử brom.
Khi đó: 0,1 lít khí etilen (đktc) làm mất màu tối đa 50 ml dung dịch nước brom.
Vậy 0,1 lít khí axetilen (đktc) thì có thể làm mất màu tối đa 50.2 = 100 ml dung dịch nước brom.
Câu 8
Cho các chất axetilen, vinyl axetilen, stiren, toluen, hexan, benzen. Trong các chất trên, số chất phản ứng được với dung dịch nước brom là
Lời giải
Đáp án A
Các chất phản ứng được với dung dịch nước brom: axetilen, vinyl axetilen, stiren.
Lời giải
Đáp án A
Để phân biệt các chất lỏng sau: benzen, toluen và stiren thì dùng dung dịch KMnO4.
Hiện tượng:
- Stiren làm mất màu dung dịch KMnO4 ngay nhiệt độ thường.
3C6H5 – CH = CH2 + 2KMnO4 + 4H2O ⟶ 3C6H5 – CH(OH) – CH2 – OH + 2MnO2 + 2KOH
- Benzen không làm mất màu dung dịch KMnO4 ở nhiệt độ thường và kể cả khi đun nóng.
- Toluen không làm mất màu dung dịch KMnO4 ở nhiệt độ thường nhưng làm mất màu khi đun nóng.
C6H5CH3 + 2KMnO4 C6H5COOK + 2MnO2 + KOH + H2O
Lời giải
Đáp án A
Benzen không làm mất màu dung dịch KMnO4 ở nhiệt độ thường và kể cả khi đun nóng.
Lời giải
Đáp án D
CH2 = CH – CH2 – CH3: but-1-en
Lời giải
Đáp án C
C sai vì anken không tan trong nước.
Lời giải
Đáp án B
Etilen làm mất màu dung dịch KMnO4 thuộc loại phản ứng oxi hóa không hoàn toàn.
Phương trình hóa học:
3CH2 = CH2 + 2KMnO4 + 4H2O ⟶ 3HO – CH2 – CH2 – OH + 2MnO2 + 2KOH
Lời giải
Đáp án C
Gọi công thức của anken có dạng CnH2n với n ≥ 2.
Số nguyên tử C trong X là \(\frac{{{n_{C{O_2}}}}}{{{n_X}}} = \frac{{0,3}}{{0,1}} = 3\)
⇒ Công thức phân tử của X là C3H6.
Lời giải
Đáp án D
2-methylbuta-1,3-diene có công thức cấu tạo là CH2=C(CH3)-CH=CH2.
Câu 16
Oxi hoá hoàn toàn 0,1 mol hỗn hợp X gồm 2 ankan. Sản phẩm thu được cho đi qua bình 1 đựng H2SO4 đặc, bình 2 đựng dung dịch Ba(OH)2 dư thì khối lượng của bình 1 tăng 6,3 gam và bình 2 có m gam kết tủa xuất hiện. Giá trị của m là
Lời giải
Đáp án D
Ta có: \({n_{{H_2}O}} = \frac{{6,3}}{{18}} = 0,35\,mol\)
⇒ \({n_{C{O_2}}} = {n_{{H_2}O}} - {n_{ankan}}\)= 0,35 – 0,1 = 0,25 mol
⇒ \({n_{BaC{O_3} \downarrow }} = {n_{C{O_2}}} = 0,25\;mol\)
⇒ \({m_{BaC{O_3}}} = 0,25.197 = 49,25\)gam
Lời giải
Đáp án C
Chỉ có C2H2 phản ứng với dung dịch AgNO3 trong NH3 tạo ra kết tủa màu vàng nhạt.
CH ≡ CH + 2AgNO3 + 2NH3 → Ag – C ≡ C – Ag↓ + 2NH4NO3
Hai khí còn lại dẫn qua dung dịch brom thì C2H4 phản ứng bị giữ lại, C2H6 không phản ứng thoát ra ngoài.
CH2 = CH2 + Br2 ⟶ CH2Br – CH2Br
Lời giải
Đáp án B
Trùng hợp CH2 = CH2 thu được polietilen.
Phương trình trùng hợp:
n CH2 = CH2 (– CH2 – CH2 –)n
Câu 19
Cho đất đèn chứa 80% CaC2 tác dụng với nước thu được 17,92 lít axetilen (đktc). Khối lượng đất đèn đã dùng là
Cho đất đèn chứa 80% CaC2 tác dụng với nước thu được 17,92 lít axetilen (đktc). Khối lượng đất đèn đã dùng là
Lời giải
Đáp án D
Phương trình phản ứng:
CaC2 + 2H2O → C2H2 + Ca(OH)2
⇒ \({n_{Ca{C_2}}} = {n_{{C_2}{H_2}}} = \frac{{17,92}}{{22,4}} = 0,8\,mol\)
⇒ Khối lượng đất đèn cần dùng là:
\(m = \frac{{0,8.64}}{{80\% }} = 64\,gam\)
Lời giải
Đáp án C
Để làm sạch etilen có lẫn axetilen có thể dẫn hỗn hợp qua dung dịch AgNO3/NH3 dư. Khí axetilen phản ứng bị giữ lại trong dung dịch, etilen không phản ứng thoát ra ngoài.
CH ≡ CH + 2AgNO3 + 2NH3 → Ag – C ≡ C – Ag↓ + 2NH4NO3
Lời giải
Đáp án B
k = \(\frac{{5.2 - 12 + 2}}{2} = 0\)
⇒ Đồng phân ankan
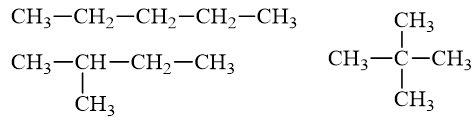
Câu 22
Xác định X, Z trong chuỗi sau: CH4 → X → Y→ Z → Cao su buna (với điều kiện phản ứng có đủ). X, Z lần lượt là
Xác định X, Z trong chuỗi sau: CH4 → X → Y→ Z → Cao su buna (với điều kiện phản ứng có đủ). X, Z lần lượt là
Lời giải
Đáp án C
CH4 ⟶ C2H2 (X) ⟶ C4H4 (Y) ⟶ C4H6 (Z) ⟶ Cao su buna
Phương trình hóa học:
2CH4 CH ≡ CH + 3H2
2CH ≡ CH CH ≡ C – CH = CH2
CH ≡ C – CH = CH2 + H2 CH2 = CH – CH = CH2
n CH2 = CH – CH = CH2 (– CH2 – CH = CH – CH2 –)n
Câu 23
Cho các chất (1) H2/Ni, t°; (2) dung dịch Br2; (3) dung dịch AgNO3 /NH3; (4) dung dịch KMnO4. Số chất etilen phản ứng được là
Lời giải
Đáp án C
Etilen phản ứng được với (1) H2/Ni, t°; (2) dung dịch Br2; (4) dung dịch KMnO4.
Phương trình hóa học:
CH2 = CH2 + H2 CH3 – CH3
CH2 = CH2 + Br2 ⟶ CH2Br – CH2Br
3CH2 = CH2 + 2KMnO4 + 4H2O ⟶ 3HO – CH2 – CH2 – OH + 2MnO2 + 2KOH
Lời giải
Đáp án A
Sản phẩm của quá trình đime hóa axetilen là vinyl axetilen.
Phương trình hóa học:
2CH ≡ CH CH ≡ C – CH = CH2
Lời giải
Đáp án C
Benzen không tác dụng với dung dịch KMnO4 ở nhiệt độ thường và cả khi đun nóng.
Lời giải
Đáp án D
Chất thỏa mãn là but-1-en.
Phương trình hóa học:
CH2 = CH – CH2 – CH3 + HCl ⟶ CH3 – CHBr – CH2 – CH3
Câu 27
Hiđro hóa hoàn toàn hiđrocacbon mạch hở X thu được isopentan. Số công thức cấu tạo có thể có của X là
Lời giải
Đáp án D
Các công thức cấu tạo có thể có của X là:
CH3 – CH(CH3) – CH = CH2; CH3 – C(CH3) = CH – CH3;
CH2 = C(CH3) – CH2 – CH3
CH3 – C(CH3) = C = CH2; CH2 = C(CH3) – CH = CH2;
CH3 – CH(CH3) – C ≡ CH; CH2 = C(CH3) – C ≡ CH
Câu 28
Hỗn hợp khí X gồm etilen, metan, propin và vinyl axetilen có tỉ khối so với H2 là 17. Đốt cháy hoàn toàn 0,05 ml hỗn hợp X rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 (dư) thì khối lượng bình tăng thêm m gam. Giá trị của m là
Lời giải
Đáp án D
Đặt công thức phân tử của X là CxH4.
Ta có: MX = 17.2 = 34 ⇒ 12x + 4 = 34 ⇒ x = 2,5
\({n_{C{O_2}}}\) = 0,05.2,5 = 0,125 (mol); \({n_{{H_2}O}}\)= 0,05.2 = 0,1 mol
⇒ m = 0,125.44 + 0,1.18 = 7,3 (gam)
Câu 29
Ba hiđrocacbon X, Y, Z là đồng dẳng kế tiếp, khối lượng phân tử của Z bằng 2 lần khối lượng phân tử của X. Các chất X, Y, Z thuộc dãy đồng đẳng
Ba hiđrocacbon X, Y, Z là đồng dẳng kế tiếp, khối lượng phân tử của Z bằng 2 lần khối lượng phân tử của X. Các chất X, Y, Z thuộc dãy đồng đẳng
Câu 30
Hỗn hợp khí X gồm 0,1 mol C2H2; 0,2 mol C2H4 và 0,3 mol H2. Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 11. Hỗn hợp Y phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
Lời giải
Đáp án B
Áp dụng bảo toàn khối lượng: mY = mX = 0,1.26. + 0,2.28 + 0,3.2 = 8,8 (gam)
Mà MY = 11.2 = 22 ⇒ nY = \(\frac{{8,8}}{{22}}\) = 0,4 mol
Số mol H2 tham gia phản ứng là: nX – nY = (0,1 + 0,2 + 0,3) – 0,4 = 0,2 mol
Ta có:\({n_{{H_2}}}\)phản ứng + \({n_{B{r_2}}}\)= \(2{n_{{C_2}{H_2}}} + {n_{{C_2}{H_4}}}\)
⇒ \({n_{B{r_2}}}\)= 2.0,1 + 0,2 - 0,2 = 0,2 mol
635 Đánh giá
50%
40%
0%
0%
0%