Giải SBT Hóa học 12 KNTT Bài 17: Ôn tập chương 5 có đáp án
28 người thi tuần này 4.6 642 lượt thi 17 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
Đáp án đúng là: B
Cặp Na+/Na có thế điện cực chuẩn là -2,713 < 0.
Lời giải
Đáp án đúng là: D
Kí hiệu cặp oxi hoá - khử tương ứng với quá trình khử: Fe(OH)3 + le ⇌ Fe(OH)2 + OH- là Fe(OH)3/Fe(OH)2.
Lời giải
Đáp án đúng là: D
Trong dãy điện hoá của kim loại, khi đi từ trái sang phải, tính oxi hoá của cảc ion kim loại tăng dần.
Lời giải
Đáp án đúng là: A
Trong pin điện hoá Zn - Cu, ở anode (cực âm) xảy ra quá trình oxi hoá Zn thành ion Zn2+.
Lời giải
Đáp án đúng là: D
Khi điện phân dung dịch NaCl bằng dòng điện một chiều (với điện cực trơ, có màng ngăn xốp) thì ở cathode xảy ra quá trình khử H2O thành H2 và OH-.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
Ở điều kiện chuẩn, cho bột Cu dư vào dung dịch Fe2(SO4)3 tới khi phản ứng hoàn toàn, thu được chất rắn X và dung dịch Y
Cho biết:
Cặp oxi hoá - khử
Fe2+/Fe
Cu2+/Cu
Fe3+/Fe2+
Thế điện cực chuẩn (V)
-0,44
+0,340
+0,771
b) Cu có tính khử mạnh hơn Fe2+ ở điều kiện chuẩn.
Ở điều kiện chuẩn, cho bột Cu dư vào dung dịch Fe2(SO4)3 tới khi phản ứng hoàn toàn, thu được chất rắn X và dung dịch Y
Cho biết:
|
Cặp oxi hoá - khử |
Fe2+/Fe |
Cu2+/Cu |
Fe3+/Fe2+ |
|
Thế điện cực chuẩn (V) |
-0,44 |
+0,340 |
+0,771 |
b) Cu có tính khử mạnh hơn Fe2+ ở điều kiện chuẩn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
Xét quá trình hoạt động của một pin điện hoá Cu – Ag được thiết lập ở các điều kiện như hình vẽ bên.
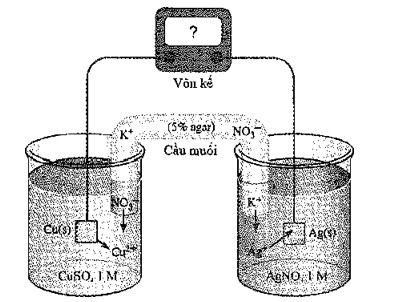
Cho thế điện cực chuẩn của các cặp Cu2+/Cu và Ag+/Ag lần lượt là +0,340 V và +0,799 V.
a) Giá trị sức điện động chuẩn của pin điện hoá trên là 0,459 V.
b) Ở anode xảy ra quá trình oxi hoá Cu, ở cathode xảy ra quá trình khử Ag+.
c) Điện cực Cu tăng khối lượng, điện cực Ag giảm khối lượng.
d) Phản ứng hoá học xảy ra trong pin: Cu + 2Ag+® Cu2+ + 2Ag.
Xét quá trình hoạt động của một pin điện hoá Cu – Ag được thiết lập ở các điều kiện như hình vẽ bên.

Cho thế điện cực chuẩn của các cặp Cu2+/Cu và Ag+/Ag lần lượt là +0,340 V và +0,799 V.
a) Giá trị sức điện động chuẩn của pin điện hoá trên là 0,459 V.
b) Ở anode xảy ra quá trình oxi hoá Cu, ở cathode xảy ra quá trình khử Ag+.
c) Điện cực Cu tăng khối lượng, điện cực Ag giảm khối lượng.
d) Phản ứng hoá học xảy ra trong pin: Cu + 2Ag+® Cu2+ + 2Ag.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.