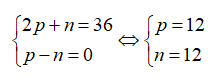Bộ 4 Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (Đề 3)
34 người thi tuần này 4.6 5.3 K lượt thi 30 câu hỏi 45 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 2
Danh sách câu hỏi:
Câu 1
A. Liên kết ion.
B. Liên kết cộng hoá trị.
C. Liên kết kim loại.
D. Liên kết hiđro.
Lời giải
Đáp án B
Câu 2
A. cộng hoá trị không phân cực.
B. hiđro.
C. cộng hoá trị phân cực.
D. ion
Lời giải
Đáp án C
Nguyên tử oxi có độ âm điện lớn hơn nhiều so với nguyên tử hiđro.
Ngoài ra, xét liên kết H – O, có hiệu độ âm điện 1,24
→ Liên kết cộng hóa trị phân cực
Câu 3
A. tăng theo chiều tăng của điện tích hạt nhân.
B. giảm theo chiều tăng của điện tích hạt nhân.
C. tăng theo chiều tăng của tính kim loại.
D. A và C đều đúng.
Lời giải
Đáp án D
Câu 4
A. .
B. .
C. .
D. .
Lời giải
Đáp án A
Gọi số proton, nơtron và electron của R lần lượt là p, n và e.
Ta có:
Vậy R là Mg.
Câu 5
A. 4.
B. 3.
C. 5.
D. 1.
Lời giải
Đâp án C
Số electron lớp ngoài cùng = STT nhóm A = 5.
Câu 6
A. Ô số 18, chu kì 3, nhóm VIIIA.
B. Ô số 18, chu kì 3, nhóm VA.
C. Ô số 18, chu kì 4, nhóm IIA.
D. Ô số 18, chu kì 3, nhóm IIA.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. và RH.
B. và .
C. và RH.
D. và .
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
A. Ô số 23 chu kì 4 nhóm VB.
B. Ô số 25 chu kì 4 nhóm VIIB.
C. Ô số 24 chu kì 4 nhóm VIB.
D. tất cả đều sai.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
A. Nguyên tố s.
B. Nguyên tố p.
C. Nguyên tố d.
D. Nguyên tố f.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
A. Trong tất cả các nguyên tử, số proton bằng số nơtron.
B. Những nguyên tử có cùng số khối thuộc cùng một nguyên tố hóa học.
C. Hạt nhân của tất cả các nguyên tử đều có proton và nơtron.
D. Nguyên tố M có Z = 11 thuộc chu kì 3 nhóm IA.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
A. Ô thứ 16, chu kỳ 3, nhóm VIA.
B. Ô thứ 9, chu kỳ 2, nhóm VIIA.
C. Ô thứ 17, chu kỳ 3, nhóm VIIA.
D. Ô thứ 8, chu kỳ 2, nhóm VIA.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
A. K và Br.
B. Ca và Br.
C. K và S.
D. Ca và S.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
A. Ion là phần tử mang điện.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion được hình thành khi nguyên tử nhường hay nhận electron.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
A. 87, 02%.
B. 26,45%.
C. 22,08%.
D. 28,02%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
A. Mg và Al.
B. Al và Mg.
C. F và Cl.
D. Cl và F.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 18
A. [Ne] và [Ar].
B. [Ar] và [Ne].
C. [He] và [Ar].
D. Cả A và C.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 19
A. Be.
B. Mg.
C. Ca.
D. Ba.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 20
A. C.
B. Si.
C. N.
D. S.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 22
A. Li và Na.
B. Na và K.
C. Li và K.
D. K và Rb.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 23
A. Electron cuối cùng phân bố trên phân lớp s hoặc p.
B. Số thứ tự nhóm nhóm A bằng số electron ngoài cùng.
C. Electron hóa trị bằng electron ngoài cùng.
D. Electron cuối cùng phân bố trên phân lớp d hoặc f.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 25
A. O (oxi).
B. F (flo).
C. Cl (clo).
D. Na (natri).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 26
A. Ở chu kỳ 3, nhóm IIIA.
B. Ở chu kỳ 2, nhóm IIIA.
C. Ở chu kỳ 3, nhóm IA.
D. Ở chu kỳ 2, nhóm IIA.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 29
A. Hóa trị cao nhất với oxi.
B. Tính kim loại và tính phi kim.
C. Nguyên tử khối.
D. Số electron ở lớp ngoài cùng.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 30
A. kim loại và kim loại.
B. kim loại và khí hiếm.
C. phi kim và kim loại.
D. khí hiếm và kim loại.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.