Giải SGK Hóa học 12 CTST Bài 12: Thế điện cực và nguồn điện hoá học có đáp án
37 người thi tuần này 4.6 1 K lượt thi 19 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
- Cấu tạo của pin điện hoá: Pin Galvani là pin điện hoá có cấu tạo gồm hai điện cực, mỗi điện cực ứng với một cặp oxi hoá – khử và thường nối với nhau qua cầu muối.
- Nguyên tắc hoạt động của pin điện hoá: Trong pin điện hoá, quá trình oxi hoá và quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hoá qua dây dẫn. Khi đó, năng lượng của phản ứng hoá học sẽ chuyển thành năng lượng điện.
Lời giải
- Quá trình (2): Cu2+ + 2e ⇌ Cu
Cặp oxi hoá – khử: Cu2+/Cu.
- Quá trình (3): Ag+ + 1e ⇌ Ag
Cặp oxi hoá – khử: Ag+/Ag.
Lời giải
Các cặp oxi hoá – khử của kim loại Na, Mg và Al lần lượt là: Na+/Na; Mg2+/Mg và Al3+/Al.
Lời giải
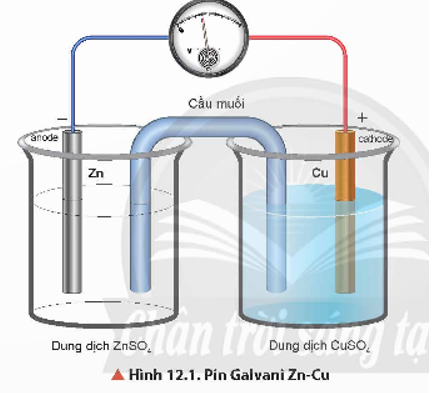
- Cấu tạo của pin Galvani Zn – Cu: gồm điện cực kẽm và điện cực đồng được nối với nhau bởi cầu muối (thường chứa dung dịch KCl bão hoà).
- Điện cực âm, anode (-): Xảy ra quá trình oxi hoá Zn:
Zn → Zn2+ + 2e
- Điện cực dương, cathode (+): Xảy ra quá trình khử ion Cu2+:
Cu2+ + 2e → Cu
- Electron chuyển từ thanh Zn qua dây dẫn đến thanh Cu. Cầu muối đóng vai trò khép kín mạch và trung hoà điện tích của dung dịch ở hai điện cực.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.