Giải SGK Hóa học 12 CTST Bài 18: Nguyên tố nhóm IIA có đáp án
49 người thi tuần này 4.6 633 lượt thi 23 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi giữa kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi giữa kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi giữa kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi giữa kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi giữa kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi giữa kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi giữa kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi giữa kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
* Kim loại nhóm IIA:
- Tính chất vật lí: Nhiệt độ nóng chảy, khối lượng riêng và độ cứng của kim loại nhóm IIA cao hơn so với kim loại nhóm IA cùng chu kì. Kim loại nhóm IIA là những kim loại nhẹ (D < 5 gam/cm3).
- Tính chất hoá học: Kim loại nhóm IIA có tính khử mạnh, tính khử tăng dần từ Be đến Ba.
* Một số hợp chất của kim loại nhóm IIA:
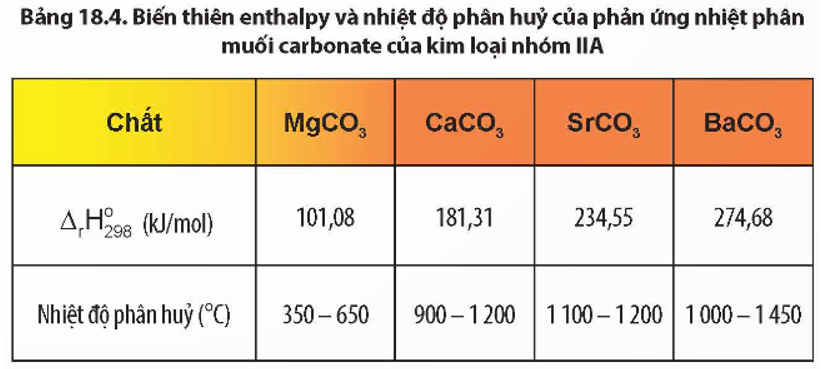
- Độ bền nhiệt của muối carbonate, muối nitrate của kim loại nhóm IIA có xu hướng tăng dần từ muối của Mg2+ đến muối của Ba2+.
- Về tính tan:
+ Các muối nitrate đều tan.
+ Trừ BeCO3, các muối carbonate khác không tan trong nước.
+ Các muối BeSO4, MgSO4 tan; SrSO4 và CaSO4 ít tan; BaSO4 không tan.
Lời giải
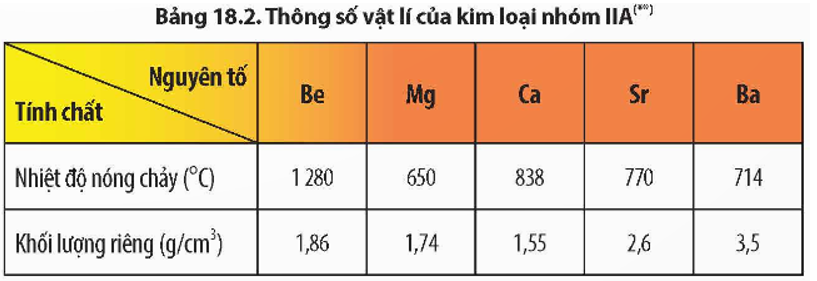
Nhiệt độ nóng chảy và khối lượng riêng của các kim loại nhóm IIA không theo quy luật do cấu trúc mạng tinh thể của các kim loại nhóm IIA là khác nhau.
+ Be, Mg có mạng tinh thể lục phương;
+ Ca, Sr có mạng tinh thể lập phương tâm diện;
+ Ba có mạng tinh thể lập phương tâm khối.
Lời giải
Dự đoán:
- Kim loại nhóm IIA có tính khử mạnh, tính khử tăng dần từ Be đến Ba.
- Tính khử của kim loại nhóm IIA yếu hơn so với kim loại nhóm IA thuộc cùng một chu kì.
Lời giải
Phương trình hoá học:
a) 2Be + O2 → 2BeO.
b) 2Ca + O2 → 2CaO.
c) 2Ba + O2 → 2BaO.Lời giải
Dựa vào Bảng 18.3 ta thấy độ tan của các hydroxide trong nước tăng dần theo thứ tự:
Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.