Bộ 17 Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 11)
32 người thi tuần này 4.5 14.5 K lượt thi 30 câu hỏi 40 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 2
Danh sách câu hỏi:
Câu 1
A. Tính axit giảm, tính khử giảm.
B. Tính axit tăng, tính khử giảm.
C. Tính axit giảm, tính khử tăng.
D. Tính axit tăng, tính khử tăng.
Lời giải
Đáp án đúng là: D
- Dãy các axit HX từ HF đến HI thì tính khử và tính axit tăng dần.
Lời giải
Đáp án đúng là: A
- (a) sai vì halogen flo chỉ có số oxi hóa âm là -1.
- (b) sai vì F2không đẩy được halogen đứng sau ra khỏi dung dịch muối.
- ( c) sai vì I2gần như không tan trong nước.
- (d) đúng
Câu 3
A. FeS + HCl.
B. H2+ S.
C. Zn + H2SO4đặc, nóng.
D. CuS + H2SO4.
Lời giải
Đáp án đúng là: A
- Trong phòng thí nghiệm, người ta điều chế H2S bằng phản ứng hoá học của dung dịch axit clohiđric với sắt (II) sunfua.
FeS + 2HCl → FeCl2+ H2S↑
Câu 4
A. Cho dung dịch Na2SO3+ dung dịch H2SO4đặc.
B. Đốt cháy hoàn toàn khí H2S trong không khí.
C. Cho Na2SO3tinh thể + dung dịch H2SO4(đun nóng).
D. Cho lưu huỳnh cháy trong không khí.
Lời giải
Đáp án đúng là: C
- Trong phòng thí nghiệm, SO2được điều chế bằng cách đun nóng dung dịch H2SO4với muối Na2SO3.
Na2SO3+ H2SO4→ Na2SO4+ H2O + SO2↑
Câu 5
A. Đỏ.
B. Xanh.
C. Không xác định.
D. Không đổi màu.
Lời giải
Đáp án đúng là: B
HBr + NaOH → NaBr + H2O
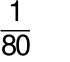
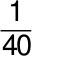
⇒NaOH dư, HBr phản ứng hết ⇒ dung dịch làm quỳ chuyển sang màu xanh.
Câu 6
A. cho từ từ axit vào nước và khuấy đều.
B. cho từ từ nước vào axit và khuấy đều.
C. cho nhanh nước vào axit và khuấy đều.
D. cho nhanh axit vào nước và khuấy đều.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
A. S → H2S → SO2→ H2SO4.
B. FeS2→ SO2→ H2S → H2SO4.
C. FeS2→ S → SO2→ SO3→ H2SO4.
D. S → SO2→ SO3→ H2SO4.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 9
A. H2SO4.
B. NaCl.
C. KMnO4.
D. HCl.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
A. Giấy quì từ màu tím chuyển sang màu xanh.
B. Giấy quì từ màu xanh chuyển sang không màu.
C. Giấy quì từ màu xanh chuyển sang màu hồng.
D. Giấy quì từ màu xanh chuyển sang màu tím.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
A. tính khử mạnh.
B. tính oxi hóa yếu.
C. tính khử yếu.
D. tính oxi hóa mạnh.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
A. NaNO3.
B. NaCl.
C. AgCl.
D. AgNO3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
A. NaOH.
B. Ba(NO3)2.
C. NaCl.
D. AgNO3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
A. Ag, Ba, Fe.
B. Cu, Zn, Na.
C. Mg, Fe, Zn.
D. Au, Pt, Al.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
A. I2.
B. F2.
C. Cl2.
D. Br2.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
A. Tất cả các muối AgX (X là halogen) đều không tan.
B. Các hidro halogenua tác dụng trực tiếp với hầu hết các kim loại.
C. Các hidro halogenua ở điều kiện thường đều là chất khí, dễ tan trong nước thành các dung dịch axit mạnh.
D. Tính axit của các axit HX tăng từ HF đến HI.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 18
A. H2S >H2CO3 >HCl.
B. H2S >HCl >H2CO3.
C. HCl >H2S >H2CO3.
D. HCl >H2CO3 >H2S.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 19
A. H2SO4vừa có tính oxi hóa, vừa có tính khử.
B. SO2 vừa có tính oxi hóa, vừa có tính khử.
C. SO3chỉ thể hiện tính oxi hóa.
D. H2S chỉ thể hiện tính khử.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 21
A. nồng độ chất phản ứng bằng nồng độ của sản phẩm.
B. phản ứng không xảy ra nữa dù có thêm tác động của các yếu tố bên ngoài như: nhiệt độ, nồng độ, áp suất.
C. nhiệt độ phản ứng không đổi.
D. tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 25
A. Cu.
B. Zn.
C. Ag.
D. Fe.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 26
A. 6 và 3.
B. 6 và 6.
C. 3 và 3.
D. 2 và 3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 27
A. 36.
B. 33.
C. 34.
D. 35.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
 (C6H10O5)n+ 6nO2
(C6H10O5)n+ 6nO2 2H2+ O2
2H2+ O2 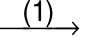 HCl
HCl 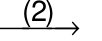 Cl2
Cl2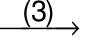 H2SO4
H2SO4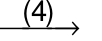 SO2
SO2