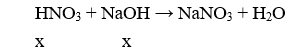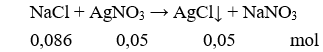Bộ 12 Đề thi Hóa học 11 Giữa kì 1 có đáp án (Đề 4)
31 người thi tuần này 4.6 10.5 K lượt thi 20 câu hỏi 45 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi giữa kì 2 Hóa 11 Kết nối tri thức có đáp án - Đề 2
Bộ 3 đề thi giữa kì 2 Hóa 11 Kết nối tri thức có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 11 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 11 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi giữa kì 2 Hóa 11 Chân trời sáng tạo có đáp án - Đề 3
Bộ 3 đề thi giữa kì 2 Hóa 11 Chân trời sáng tạo có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 11 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 11 Cánh diều cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
Lời giải
Câu 3
A. pH = 2.
B. pH = 7.
C. pH > 7.
D. pH < 7.
Lời giải
Chọn B
Do hai dung dịch và NaOH có cùng thể tích và cùng nồng độ nên chúng có cùng số mol (x mol).
Vậy dung dịch sau phản ứng có pH = 7.
Lời giải
Câu 5
A. 7,175g.
B. 71,8g.
C. 72,75g.
D. 73g.
Lời giải
Chọn A
Vậy m↓ = 0,05.143,5 = 7,175 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. chất khi tan trong nước phân li ra anion .
B. chất khi tan trong nước phân li ra cation .
C. chất khi tan trong nước phân li ra anion .
D. Tất cả đều sai.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
A. 200 ml.
B. 100 ml.
C. 150 ml.
D. 50 ml.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
A. tích số tan của nước.
B. tích số phân li của nước.
C. độ điện li của nước.
D. tích số ion của nước.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
A. electron.
B. phân tử.
C. ion.
D. nguyên tử.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
A. Không tồn tại phân tử trong dung dịch các chất điện li.
B. Nồng độ các trong dung dịch.
C. Các ion tồn tại trong dung dịch.
D. Bản chất của phản ứng trong dung dịch các chất điện li.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
A. NaCl nóng chảy.
B. nóng chảy.
C. HBr hoà tan trong .
D. NaCl rắn, khan.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
A. Muối tạo bởi bazơ yếu và axit mạnh.
B. Muối vẫn còn hiđro có khả năng phân li ra cation .
C. Muối vẫn còn hiđro trong phân tử.
D. Muối có khả năng phản ứng với bazơ.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.