Bộ 10 Đề thi Hóa học 11 Học kì 2 có đáp án (Đề 10)
23 người thi tuần này 4.6 10.1 K lượt thi 4 câu hỏi 45 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi cuối kì 2 Hóa 11 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 11 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 11 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 11 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 11 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 11 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 11 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 11 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
1.
Axetilen: CHCH; Anđehit axetic: CH3CHO.
Sơ đồ phản ứng:
C6H6C6H5Cl C6H5ONaC6H5OH
C2H2C2H4CH3CHO.
(1) 3CHCH C6H6
(2) C6H6+ Cl2C6H5Cl + HCl
(3) C6H5Cl + NaOH C6H5ONa + NaCl
(4) C6H5ONa + CO2+ H2O C6H5OH + NaHCO3
(5) CHCH + H2CH2=CH2
(6) 2CH2=CH2+ O22CH3CHO
2.
- Trích mẫu thử.
- Dùng quỳ tím cho vào từng mẫu thử:
+ Dung dịch làm quỳ tím hóa đỏ là CH3COOH.
+ Không làm đổi màu quỳ tím: CH3CHO, C6H5OH, C2H5OH, C6H14(nhóm I)
- Dùng dung dịch Br2cho vào từng mẫu thử ở nhóm I.
+ Thấy tạo thành kết tủa trắng là C6H5OH.
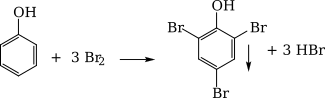
+ Chỉ thấy dung dịch Br2nhạt màu là CH3CHO.
CH3CHO + Br2+ H2O CH3COOH + 2HBr
+ Không có hiện tượng gì: C2H5OH, C6H14.
Dùng kim loại Na:
+ Thấy có khí thoát ra là C2H5OH.
C2H5OH + Na C2H5ONa + \(\frac{1}{2}\) H2
+ Không có hiện tượng gì là C6H14.
Lời giải
1.
a. Anđehit axetic có tính khử.
CH3CHO + 2AgNO3+ 3NH3+ H2O CH3COONH4+ 2Ag + 2NH4NO3
b. Benzen thể hiện tính chất của hiđrocacbon no.
C6H6+ Br2C6H5Br + HBr (phản ứng thế)
c. Stiren tham gia phản ứng trùng hợp.
nC6H5CH=CH2(-CH(C6H5)-CH2-)n
d. Trong phân tử phenol, ảnh hưởng của gốc phenyl đến nhóm -OH.
C6H5OH + NaOH C6H5ONa + H2O
2.
Tinh bột: (C6H10O5)n.
(C6H10O5)n+ nH2O nC6H12O6(glucozơ)
C6H12O62C2H5OH + 2CO2
Điều chế etyl clorua (C2H5Cl):
C2H5OH + HCl C2H5Cl + H2O
Điều chế đietyl ete ((C2H5)2O):
2C2H5OH (C2H5)2O + H2O
Điều chế polietilen (-CH2-CH2-)n:
nCH2=CH2(-CH2-CH2-)n
3.
Phenol: C6H5OH; metanol: CH3OH; etyl clorua: C2H5Cl.
Phương trình hóa học:
C6H5OH + KOH C6H5OK + H2O
CH3OH + CuO HCHO + Cu + H2O
CH3OH + HCl CH3Cl + H2O
C2H5Cl + KOH C2H5OH + KCl
Lời giải
X gồm: ancol propylic (CH3CH2CH2OH) và phenol (C6H5OH).
Phần I: \({n_{B{r_2}}}\)= 0,15 (mol).
Phương trình hóa học:

nphenol= n=\(\frac{{{n_{B{r_2}}}}}{3}\) = 0,05 (mol).
a = m= 0,05×331 = 16,55 (gam).
Phần II: \({n_{{H_2}}}\)= 0,075 (mol).
Phương trình hóa học;
CH3CH2CH2OH + Na CH3CH2CH2ONa + \(\frac{1}{2}\)H2
C6H5OH + Na C6H5ONa + \(\frac{1}{2}\)H2
\({n_{{C_3}{H_7}OH}} + {n_{{C_6}{H_5}OH}} = 2{n_{{H_2}}} = 0,15\)(mol)
\({n_{{C_3}{H_7}OH}}\) = 0,15 – 0,05 = 0,1 (mol)
m = mX= \({m_{{C_3}{H_7}OH}} + {m_{{C_6}{H_5}OH}}\)= 2×(0,1×60 + 0,05×94) = 21,4 (gam).
Lời giải
X gồm glixerol (C3H5(OH)3) và một ankanol A (CnH2n+2O).
a. Sơ đồ phản ứng: X + O2CO2+ H2O.
\({n_{{O_2}}}\)= 0,975 (mol); \({n_{{H_2}O}}\)= 1 (mol).
\({n_{Cu{{(OH)}_2}}}\)= 0,025 (mol).
\({n_{{C_3}{H_5}{{(OH)}_3}}} = 2{n_{Cu{{(OH)}_2}}}\)= 2×0,025×3 = 0,15 (mol) (do chỉ tác dụng 1/3 hỗn hợp X).
Gọi số mol của ankanol A là x (mol) và số mol CO2sinh ra khi đốt cháy X là y (mol).
Ta có: nX= \({n_{{H_2}O}} - {n_{C{O_2}}}\)
0,15 + x = 1 – y x + y = 0,85 (*).
Bảo toàn nguyên tố O: nO(X)+ 2\({n_{{O_2}}}\)= 2\({n_{C{O_2}}}\)+ \({n_{{H_2}O}}\).
3×0,15 + x + 2×0,975 = 2y + 1
x – 2y = -1,4 (**).
Từ (*) và (**), suy ra: x = 0,1; y = 0,75.
Ta có: \({n_{C{O_2}}}\)= 3×0,15 + 0,1×n = 0,75 n = 3
Ankanol A là C3H8O.
a = mX= 0,15×92 + 0,1×60 = 19,8 (gam).
b. A Y (anđehit + H2O + Ancol dư).
A là ancol bậc I: CH3CH2CH2OH.
CH3CH2CH2OH + CuO CH3CHO + H2O + Cu
nancol(pư)= \({n_{{H_2}O}}\).
nA= nancol(pư) + nancol(dư) = 2\({n_{{H_2}}}\)= \(\frac{{0,448}}{{22,4}}\) = 0,02 (mol).
b = mA= 0,02×60 = 1,2 (gam).
c. \({n_{{C_3}{H_7}OH}} = \frac{3}{{60}} = 0,05\)(mol); \({n_{C{H_3}OH}} = \frac{{1,6}}{{32}} = 0,05\) (mol)
\(\sum {{n_{ancol}}} \)= 0,05 + 0,05 = 0,1 (mol).
Sơ đồ phản ứng: 2ancol Ete + H2O.
\({n_{{H_2}O}} = \frac{{{n_{ancol}}}}{2} = 0,05\)(mol).
Bảo toàn khối lượng:
mancol= mete+ \({m_{{H_2}O}}\)
3 + 1,6 = m+ 0,05×18 m= 3,7 (gam).