Đề thi Hóa 9 giữa kì 1 có đáp án (Đề 3)
18 người thi tuần này 5.0 5.8 K lượt thi 4 câu hỏi 20 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 29)
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 28)
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 27)
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 26)
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 25)
Trắc nghiệm tổng hợp Hóa 9 Chương 2: Các loại hợp chất vô cơ có đáp án - Đề 8
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 24)
Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 23)
Danh sách câu hỏi:
Lời giải
(1) 4Na + O2→ 2Na2O
(2) Na2O + H2O → 2NaOH
(3) 2NaOH + CO2→ Na2CO3+ H2O
(4) Na2CO3+ 2HCl → 2NaCl + H2O + CO2
(5) 2NaCl + 2H2O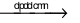 2NaOH + Cl2+ H2
2NaOH + Cl2+ H2
Lời giải
- Đánh số thứ tự và trích mẫu thử
- Cho quỳ tím vào 3 mẫu thử:
+ Mẫu làm quỳ tím hóa đỏ là HCl
+ Mẫu làm quỳ tím hóa xanh là NaOH
+ Mẫu không làm đổi màu quỳ là NaNO3và Na2SO4(1)
- Cho một lượng BaCl2vào nhóm (1), nếu:
+ Xuất hiện kết tủa trắng là Na2SO4
Phương trình phản ứng: BaCl2+ Na2SO4→ BaSO4(↓ trắng)+ 2NaCl
+ Không xảy ra hiện tượng gì thì đó là NaNO3.
Lời giải
a. Số mol của Mg là: nMg= = 0,2 mol
= 0,2 mol
Phương trình phản ứng:
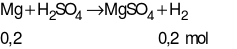
Theo phương trình phản ứng ta có: = 0,2 mol
= 0,2 mol
Suy ra thể tích khí H2thoát ra ở đktc là:
 = 0,2.22,4 = 4,48 lít
= 0,2.22,4 = 4,48 lít
b. Phương trình phản ứng:
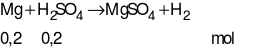
Suy ra = 0,2 mol;
= 0,2 mol; = 0,2.98 = 19,6 gam
= 0,2.98 = 19,6 gam
Vậy nồng độ phần trăm của dung dịch H2SO4cần dùng là:
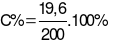 = 9,8%
= 9,8%
c. Ta có khối lượng dung dịch sau phản ứng là:
mdd sau phản ứng= 200 + 4,8 – 0,2.2 = 204,4 g
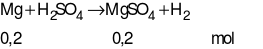
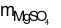 = 0,2.120 = 24 g
= 0,2.120 = 24 g
Suy ra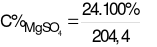 = 11,74%
= 11,74%
d. Số mol của Fe2O3là: = 0,03 mol
= 0,03 mol
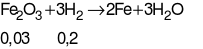
Xét tỉ lệ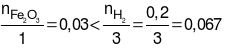
Suy ra Fe2O3hết, H2dư
Phương trình phản ứng:
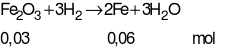
Vậy khối lượng sắt tạo thành là mFe= 0,06.56 = 3,36 gam.
Lời giải
CaO tiếp xúc lâu ngày với không khí sẽ bị giảm chất lượng do tác dụng với CO2, hơi nước … có trong không khí.
Phương trình hóa học:
CaO + CO2 → CaCO3
CaO + H2O → Ca(OH)2
Cho biết: Mg = 24, H = 1, S = 32, O = 16, Fe = 56
 Na2O
Na2O NaOH
NaOH Na2CO3
Na2CO3 NaCl
NaCl NaOH.
NaOH.