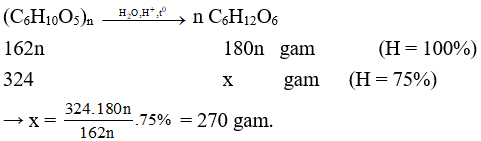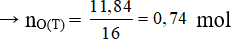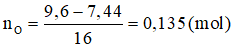Đề thi Hóa học 12 Học kì 1 chọn lọc, có đáp án - Đề 3
25 người thi tuần này 4.6 6.1 K lượt thi 30 câu hỏi 30 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Câu 1
A. 300 gam.
B. 360 gam.
C. 270 gam
D. 250 gam.
Lời giải
Đáp án C
Lời giải
Đáp án C
Tơ nilon – 6,6 là một loại tơ poliamit vì các mắt xích nối với nhau bằng các nhóm amit (– CO – NH –) .
Lời giải
Đáp án A
Thủy phân peptit X có thể thu được các đipeptit là: Gly-Ala; Ala-Val; Val-Gly.
Lời giải
Đáp án A
Quy đổi hỗn hợp peptit về ON (x mol); CH2 (y mol); O (z mol) và (t mol)
= 31,88 gam → 57x + 14y + 18z + 218t = 31,88 (1)
= 0,44 mol → x + 3t = 0,44 (2)
Muối trong B gồm: NNa (x mol); C (y mol); CCOONa (3t mol)
→ 97x + 14y + 82.3t = 41,04 hay 97x + 14y + 246t = 41,04 (3)
Biết trong T nguyên tố oxi chiếm 37,139% về khối lượng nên:
→ = 31,88.37,139% = 11,84
Hay x + z + 6t = 0,74 (4)
Từ (1); (2); (3) và (4) có x = 0,2; y = 0,14; z = 0,06; t = 0,08.
Số N trong
→ X là tripeptit (0,04 mol) và Y là tetrapeptit (0,02 mol)
(ghi chú: tính số mol X và Y bằng npeptit = = z và Số N)
Gọi số mol của Gly và Ala lần lượt a, b
→ a + b = = 0,2 và 2a + 3b = = 2x + y = 0,54
→ a = 0,06 và b = 0,14.
Gọi X là Glyu(Ala)3 – u và Y là Glyv(Ala)4 – v.
= 0,06 → 0,04u + 0,02v = 0,06 hay 2u + v = 3.
Mà X và Y đều chứa Gly và Ala nên u = 1 và v = 1 thỏa mãn.
Vậy Y là Gly(Ala)3
Lời giải
Đáp án C
Gọi số mol NO và lần lượt là x mol và y mol.
= 0,02 mol → x + y = 0,02 mol
= 0,02.14,5.2 = 0,58 gam → 30x + 28y = 0,58 gam
Giải hệ được x = y = 0,01 mol.
Do dung dịch X chỉ chứa muối nên HCl phản ứng hết.
BTKL:
= 7,44 + 0,4.36,5 + 0,05.85 – 22,47 – 0,58 = 3,24 gam → = 0,18 mol.
Giả sử muối có
Bảo toàn nguyên tố H có:
= 2.→ = 0,01 mol.
Cho NaOH dư vào X thu được kết tủa Y, nung Y trong không khí thu được rắn chứa MgO và có khối lượng 9,6 gam.
Lượng O để oxi hóa 7,44 gam hỗn hợp ban đầu lên tối đa là:
Cho AgN dư tác dụng với dung dịch X ta thu được kết tủa gồm AgCl 0,4 mol (bảo toàn Cl) và Ag.
Bảo toàn electron có:
= 0,135.2 - 0,01.8 - 0,01.3 - 0,01.10 = 0,06 mol
→ m = 0,4.143,5 + 0,06.108 = 63,88 (gam).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. Glucozơ và fructozơ đều có vị ngọt và đều ngọt nhiều hơn đường mía.
B. Glucozơ còn có tên gọi là đường nho, fructozơ được gọi là đường mật ong.
C. Glucozơ là chất rắn, dạng tinh thể, không màu, tan trong nước.
D. Glucozơ có mặt trong hầu hết các bộ phận của cây, nhất là trong quả chín; có khoảng 0,1% trong máu người.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
A. metyl axetat
B. metyl propionat.
C. etyl axetat.
D. propyl axetat
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
A. Glucozơ.
B. Tinh bột.
C. Fructozơ
D. Xenlulozơ
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
A. Chu kì 4, nhómVIIIA
B. Chu kì 4, nhóm IA.
C. Chu kì 3, nhóm IA.
D. Chu kì 3, nhóm VIIIA.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
A. quì tím hóa xanh.
B. phenolphtalein hoá xanh.
C. quì tím không đổi màu.
D. phenolphtalein không đổi màu.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
A. 21,6 gam.
B. 16,2 gam
C. 15,4 gam
D. 10,8 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
A. Nhôm
B. Bạc.
C. Vàng
D. Đồng.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
A. (1), (2), (4), (6), (7).
B. (1), (2), (3), (6), (7).
C. (1), (2), (3), (4), (5), (6).
D. (1), (2), (3), (5), (7).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
A. Este mạch vòng, đơn chức
B. Este no, đơn chức.
C. Ese có một liên kết đôi C=C chưa biết mấy chức.
D. Este 2 chức, no.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 18
A. etyl axetat.
B. metyl axetat.
C. propyl fomat
D. metyl fomat
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 19
A. glyxin
B. valin
C. axit glutamic
D. alanin.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 20
A. 13,8
B. 4,6
C. 9,2.
D. 6,975
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 21
A. xenlulozơ
B. saccarozơ.
C. protit.
D. tinh bột.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 23
A. fructozơ.
B. tinh bột
C. saccarozơ
D. glucozơ
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 24
A. Mg, Fe, Cu.
B. Mg, Cu,
C. Mg, , Ag.
D. Fe, Cu, .
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 26
A. HCOO
B.
C.
D.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 27
A. β-aminoaxit.
B. axit cacboxylic.
C. α-aminoaxit
D. este.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 30
A. 12.000.
B. 13.000.
C. 17.000
D. 15.000.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.