Đề thi cuối kì 2 Hóa 12 có đáp án (Đề 8)
21 người thi tuần này 4.6 10.8 K lượt thi 30 câu hỏi 30 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
Đáp án đúng là: B
Chất bị oxi hóa khi tác dụng với dung dịch HNO3đặc, nóng là: FeO, Fe(OH)2, FeSO4, Fe3O4.
Câu 2
A.FeSO4.
B.Fe2(SO4)3và H2SO4.
C.Fe2(SO4)3.
D.FeSO4 và H2SO4.
Lời giải
Đáp án đúng là: A
Fe3O4+ 4H2SO4→ Fe2(SO4)3+ FeSO4+ 4H2O
Fe + Fe2(SO4)3→ 3FeSO4
Fe + H2SO4dư → FeSO4 + H2
Câu 3
A.Na2O, K2O và BaO.
B.Na2O, Fe2O3 và BaO.
C.Na2O, K2O và MgO.
D.Al2O3, K2O và BaO.
Lời giải
Đáp án đúng là: A
Fe2O3, MgO và Al2O3không tan trong nước tạo ra dung dịch kiềm
Câu 4
A.K.
B.Fe.
C.Ag.
D.Mg.
Lời giải
Đáp án đúng là: A
2K + 2H2O → 2KOH + H2
2KOH + Cu(NO3)2→ Cu(OH)2↓ + 2KNO3
Cu(OH)2+ 2HCl → CuCl2+ 2H2O
Lời giải
Đáp án đúng là: D
Al, Al2O3, Al(OH)3phản ứng được với dung dịch HCl và dung dịch NaOH
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A.0,6200 mol.
B.0,7750 mol.
C.1,2400 mol.
D.0,6975 mol.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
A.Fe + CuSO4→FeSO4+ Cu.
B.Cu + H2SO4→CuSO4+ H2.
C.2Na + 2H2O→2NaOH + H2.
D.Ca + 2HCl→CaCl2+ H2.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 9
A.Dung dịch chuyển từ màu da cam sang màu vàng.
B.Dung dịch chuyển từ không màu sang màu da cam.
C.Dung dịch chuyển từ màu vàng sang màu da cam.
D.Dung dịch chuyển từ màu vàng sang không màu.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
A.sự khử ion Ca2+.
B.sự oxi hóa ion Cl-.
C.sự khử ion Cl-.
D.sự oxi hóa ion Ca2+.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
A.Thép có hàm lượng sắt cao hơn gang.
B.Sắt là nguyên tốphổbiến nhất trong vỏtráiđất.
C.Crom còn được dùng để mạ thép.
D.Gang và thépđều là hợp kim.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
A.14.
B.12.
C.13.
D.11.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
A.Al2(SO4)3, BaCl2, Na2SO4.
B.FeCl2, Ba(OH)2, AgNO3.
C.NaHCO3, NaHSO4, BaCl2.
D.NaHSO4, BaCl2, Na2CO3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
A.x < 3y.
B.x ≠ y.
C.x = 3y.
D.x >3y.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
A.25,95 gam.
B.103,85 gam.
C.38,93 gam.
D.77,86 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 19
A.2 : 9.
B.1 : 2.
C.2 : 3.
D.1 : 3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 20
A.13 : 9.
B.25 : 9.
C.4 : 3.
D.7 : 3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 23
A.Các kim loại kiềm đứng ở cuối mỗi chu kì.
B.Các kim loại kiềm đứng ở đầu mỗi chu kì (trừ chu kì 1).
C.Các kim loại kiềm thuộc nhóm IA.
D.Các kim loại kiềm đứng ngay sau các nguyên tố khí hiếm.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 24
A.không có hiện tượng gì xảy ra.
B.chỉ xuất hiện kết tủa keo trắng.
C.có bọt khí bay lên.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 25
A.Al, Fe, Ag.
B.Al, Fe, Cu.
C.Al, Cu, Ag.
D.Fe, Cu, Ag.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 26
A.Al tan trong dung dịch NaOH cũng như trong HNO3đặc nguội.
B.Na là kim loại có tính khử mạnh hơn Mg và Al.
C.Na, Mg, Al đều khử dễ dàng ion H+trong dung dịch axit HCl, H2SO4loãng thành hiđro tự do.
D.Al có thể khử được nhiều oxit kim loại như Fe2O3, Cr2O3, … ở nhiệt độ cao thành kim loại tự do.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 27
A.60 ml.
B.120 ml.
C.1,20 lít.
D.240 ml.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 28
A.có màng oxit Al2O3bền vững bảo vệ.
B.nhôm có tính thụ động với không khí và nước.
C.có màng hiđroxit Al(OH)3bền vững bảo vệ.
D.nhôm là kim loại kém hoạt động.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 29
A.HCl.
B.Na2CO3.
C.H2SO4.
D.NaHCO3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 30
A.Trộn dung dịch NaCl với dung dịch AgNO3.
B.Điện phân NaCl nóng chảy.
C.Dẫn khí clo vào dung dịch NaOH.
D.Điện phân dung dịch NaCl.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
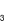 , Cl
, Cl , SO
, SO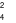 . Chất được dùng để làm mềm mẫu nước cứng trên là
. Chất được dùng để làm mềm mẫu nước cứng trên là