Đề thi cuối kì 2 Hóa 12 có đáp án (Đề 9)
21 người thi tuần này 4.6 10.8 K lượt thi 36 câu hỏi 30 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
Đáp án đúng là: C
NaHCO3không tác dụng với CO2.
NaHCO3+ HCl → NaCl + CO2+ H2O
NaHCO3+ NaOH → Na2CO3+ H2O
2NaHCO3+ 2KOH → Na2CO3+ K2CO3+ 2H2O
Câu 2
A. 7,6.
B. 10,2.
C. 15
D. 11,4.
Lời giải
Đáp án đúng là: D
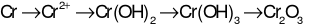


Lời giải
Đáp án đúng là: D
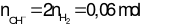
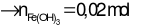
→ m = 0,02. 107 = 2,14 gam
Lời giải
Đáp án đúng là: B
AlCl3không có tính lưỡng tính.
Câu 5
A. 40,5 g
B. 27 g
C. 12,5 g
D. 45 g
Lời giải
Đáp án đúng là: D
2Al + Cr2O3→ Al2O3+ 2Cr
Theo lí thuyết:
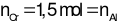
Do H = 90% nên: 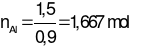
→ mAl= 45g
Câu 6
A. NaCl và Ca(OH)2
B. Na2CO3và Na3PO4
C. Na2CO3và Ca(OH)2.
D. Na2CO3và HCl.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. Tính chất hóa học đặc trưng của kim loại là tính khử.
B. Ăn mòn hóa học phát sinh dòng điện.
C. Bản chất của ăn mòn kim loại là quá trình oxi hóa - khử.
D. Nguyên tắc chung để điều chế kim loại là khử ion kim loại thành nguyên tử kim loại.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
A. 27g
B. 28g
C. 29g.
D. 30g
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 9
A. 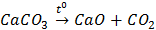 CaCO3
CaCO3  CaO + CO2
CaO + CO2
B. 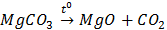 MgCO3
MgCO3 MgO + CO2
MgO + CO2
C.2NaHCO3 Na2CO3+ CO2+ H2O
Na2CO3+ CO2+ H2O
D.Na2CO3 Na2O + CO2
Na2O + CO2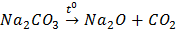
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
A. 0,112.
B. 0,224.
C. 0,448.
D. 0,896.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
A. Có kết tủa trắng sau đó tan.
B. Có kết tủa trắng
C. Không có kết tủa.
D. Không hiện tượng
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
Thể tích dung dịch HCl 0,3 M cần để trung hoà 100 ml dung dịch hỗn hợp NaOH 0,1M và Ba(OH)20,1 M là:
A. 100 ml
B. 250 ml
C. 150 ml
D. 200 ml
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
A. da cam
B. đỏ
C. vàng
D. xanh
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
A. KNO3và Na2CO3
B. Na2SO4và BaCl2
C. Ba(NO3)2và Na2CO3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
A. 0,032
B. 0.048
C. 0,06
D. 0,04
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 18
A. SO2và NO2.
B. NH3và HCl.
C. H2S và N2.
D. CO2và O2.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 19
A. 2,24 hoặc 11,2 lít
B. 11,2 lít
C. 2,24 lít
D. 2,24 hoặc 3,36 lít
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 20
A. kim loại Ba.
B. kim loại Mg.
C. kim loại Ag.
D. kim loại Cu.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 21
A. H2SO4loãng.
B. HNO3loãng.
C. NaCl loãng.
D. NaOH loãng
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 23
A. 27,84g.
B. 13,32g.
C. 13,92g.
D. 8,88g.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 24
A. Cùng tác dụng với HCl tạo ra muối có mức oxi hóa là +3.
B. Cùng tác dụng với dung dịch NaOH dư.
C. Cùng tác dụng với khí clo tạo ra muối có dạng MCl3.
D. Cùng bị thụ động trong HNO3đặc nguội.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 25
A. Mg.
B. Na.
C. Ca.
D. K.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 26
A. 0,015 lít
B. 0,01 lít
C. 0,03 lít
D. 0,02 lít
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 30
A. sự oxi hoá Fe và sự khử Cu2+
B. sự oxi hoá Fe và sự oxi hoá Cu
C. sự khử Fe2+và sự oxi hoá Cu
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.