280 Bài tập Kim loại kiềm, kiềm thổ, nhôm cực hay có lời giải chi tiết (P2)
18 người thi tuần này 4.6 9.5 K lượt thi 40 câu hỏi 50 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Câu 1
A. 14,865 gam
B. 14,775 gam
C. 14,665 gam
D. 14,885 gam
Lời giải
Đáp án D
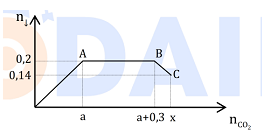
- Áp dụng qui tắc đường chéo => nNO = 0,1 mol và nN2O = 0,1mol
=> nNO3- trong muối = 3nNO + 8nN2O + 9nNH4+ = 1,1 + 9x
Ta có: m muối = mKL + 18nNH4+ + 62nNO3-
=> 122,3 = 25,3 + 18x + 62 (1,1 + 9x) => x = 0,05mol
=> nHNO3 = 10nNH4+ + 4nNO + 10nN2O = 1,9mol
Câu 2
A. Li.
B. Na.
C. K.
D. Ba.
Lời giải
Đáp án B
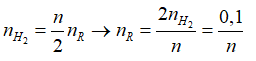
![]()
=> R = 23n
![]()
Câu 3
A. 100ml.
B. 200ml.
C. 300ml.
D. 600ml.
Lời giải
Đáp án B
nOH- = 2nH2 = 0,06 mol
Số mol H+ cần để trung hòa 1/3 dung dịch A là: nH+ = 0,06/3 = 0,02 mol
=> V = 0,02/0,1 = 0,2 (lít) = 200 ml
Lời giải
Đáp án B
Đặt nH2 = x => nH2SO4 = x
BTKL: mKL + mH2SO4 = m muối + mH2
8,975 + 98x = 32,975 + 2x => x = 0,25 mol
=> V = 5,6 lít
Câu 5
A. Na2SO4, HNO3.
B. HNO3, KNO3.
C. HCl, NaOH.
D. NaCl, NaOH.
Lời giải
Đáp án C
6HNO3 + Al2O3 2Al(NO3)3 + 3H2O
6HCl + Al3O2 2AlCl3 + 3H2O
2NaOH + Al3O2 2NaAlO2 + H2O
A sai vì Na2SO4 không tác dụng với Al2O3
B sai vì KNO3 không tác dụng với Al2O3
D sai vì NaCl không tác dụng với Al2O3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. Mg.
B. Al.
C. Zn.
D. Fe.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
A. Cho dung dịch AlCl3 dư vào dung dịch NaOH.
B. Cho Ba dư vào dung dịch NH4HCO3
C. Cho dung dịch NaHCO3 dư vào dung dịch Ca(OH)2
D. Cho dung dịch HCl dư vào dung dịch NaAlO2.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
A. 0,1 và 0,15.
B. 0,3 và 0,25.
C. 0,8 và 0,25.
D. 0,3 và 0,15.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
A. Fe2O3.
B. Fe3O4.
C. FeO.
D. Không xác định được.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
A. 1,28 gam.
B. 5,12 gam.
C. 2,11 gam.
D. 3,10gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
A. 3,170 g.
B. 2,005 g.
C. 4,020 g.
D. 3,070 g.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 18
A. 0,75 và 50%.
B. 0,5 và 66,67%.
C. 0,5 và 84%.
D. 0,75 và 90%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 20
A. 14,58 gam.
B. 15,35 gam.
C. 15,78 gam.
D. 14,15 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 21
A. V = 22,4.(a-b)
B. V = 22,4.(a+b)
C. V = 11,2.(a-b)
D. V = 11,2.(a+b)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 22
A. 0,02 lít.
B. 0,01 lít.
C. 0,05 lít.
D. 0,04 lít.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 23
A. 1,0.
B. 0,6.
C. 2,0.
D. 0,5.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 24
A. 75,68%.
B. 24,32%.
C. 51,35%.
D. 48,65%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 25
A. 126,40.
B. 121,45.
C. 116,50.
D. 99,32.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 27
A. 18,2.
B. 15,6.
C. 54,6.
D. 7,8.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 29
A. 10,08.
B. 3,92.
C. 5,04.
D. 6,72.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 30
A. 47,5
B. 40,4.
C. 53,9.
D. 68,8.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 31
A. 0,52.
B. 0,56.
C. 0,50.
D. 0,58.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 32
A. BaCO3, Na2CO3.
B. BaO, Na2O.
C. BaO, Na2CO3.
D. BaCO3, Na2O
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 33
A. có nhiệt độ nóng chảy thấp.
B. có số oxi hóa là +1 trong các hợp chất.
C. có độ cứng cao.
D. có tính khử mạnh.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 34
A. NaOH.
B. NaAlO2
C. AlCl3.
D. Na2AlO2.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 37
A. điện phân nóng chảy AlCl3.
B. dùng CO khử Al2O3 ở nhiệt độ cao.
C. dùng Mg khử Al3+ trong dung dịch.
D. điện phân nóng chảy Al2O3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 39
A. 4 : 9.
B. 9 : 4.
C. 7 : 4.
D. 4 : 7.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 40
A. Na > Mg > Al.
B. Al > Mg > Na.
C. Mg > Al > Na.
D. Mg > Na > Al.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.