280 Bài tập Kim loại kiềm, kiềm thổ, nhôm cực hay có lời giải chi tiết (P4)
20 người thi tuần này 4.6 9.5 K lượt thi 40 câu hỏi 50 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Câu 1
A. 4,48 lít
B. 5,6 lít
C. 6,72 lít
D. 10,08 lít
Lời giải
Đáp án D
Bảo toàn e :
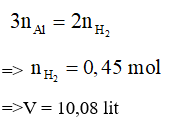
Câu 2
A. Nhôm và crom đều phản ứng với dung dịch HCl theo cùng tỉ lệ số mol
B. Nhôm có tính khử mạnh hơn crom
C. Nhôm và crom đều bị thụ động trong dung dịch H2SO4 đặc nguội
D. Nhôm và crom đều bền trong không khí và nước
Lời giải
Đáp án A
Cr+2HCl→CrCl2+H2
2Al+6HCl→2AlCl3+3H2
Câu 3
A. Al,Cu,Mg,Fe
B. Al,Cu,MgO,Fe
C. Al2O3,Cu,MgO,Fe
D. Al2O3,Cu,MgO,FeO
Lời giải
Đáp án C
Phương pháp nhiệt luyện chỉ điều chế được các kim loại sau Al
Câu 4
A. 34,2 gam
B. 102,6 gam
C. 68,4 gam
D. 51,3 gam
Lời giải
Đáp án B
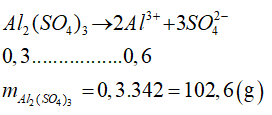
Câu 5
A. 3,06 gam
B. 2,55 gam
C. 2,04 gam
D. 2,31 gam
Lời giải
Đáp án B
X2 là Al2O3, bảo toàn Al → m = 2,04 + (0,27:27) : 2 . 102 = 2,55
Câu 6
A. 46,75%.
B. 37,5%.
C. 62,50%.
D. 53,25%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
A. Màu dung dịch K2Cr2O7bị biến đổi khi cho thêm dung dịch KOH vào.
B. Cr(OH)2 là hợp chất lưỡng tính.
C. Khi phản ứng với Cl2trong dung dịch KOH ion CrO2− đóng vai trò là chất khử.
D. Ancol etylic nguyên chất bốc cháy khi tiếp xúc với CrO3ở điều kiên thường
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 9
A. Bột của kim loại M cháy trong khí Cl2 ngay trong điều kiện thường.
B. M tan trong cả dung dịch NaOH đặc nguội và H2SO4 đặc nguội.
C. Oxit của M lưỡng tính nhưng không tan trong dung dịch NaOH loãng.
D. M là kim loại dẫn điện và dẫn nhiệt tốt nhất.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
A. dầu hoả
B. nước vôi trong
C. giấm ăn
D. ancol etylic
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
A. 20,60 gam
B. 43,40 gam
C. 21,00 gam
D. 23,25 gam
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
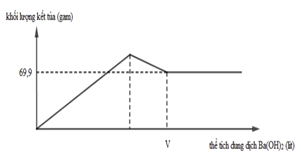
Câu 19
A. Cho 0,10 mol Ba vào dung dịch loãng chứa 0,20 mol H2SO4
B. Cho 0,150 mol Ca vào dung dịch chứa 0,225 mol NaHCO3
C. Cho 0,40 mol K vào dung dịch chứa 0,40 mol CuSO4
D. Cho 0,70 mol Na vào dung dịch chứa 0,20 mol AlCl3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 22
A. 39,2%.
B. 43,4%.
C. 35,1%.
D. 41,3%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 23
A. 15,44%
B. 42,88%
C. 17,15%
D. 20,58%
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 24
A. 13,35 gam.
B. 53,4 gam.
C. 26,7 gam.
D. 40,05 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 27
A. thủy luyện.
B. điện phân nóng chảy.
C. nhiệt luyện.
D. điện phân dung dịch.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 29
A. Na.
B. Ca.
C. Ba.
D. K.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 30
A. 20,40 gam.
B. 25,30 gam.
C. 26,40 gam.
D. 21,05 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 31
A. 18,39% và 51.
B. 21,11% và 56.
C. 13,26% và 46.
D. 24,32% và 64.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 34
A. 77,42% và 22,58%.
B. 25,8% và 74,2%.
C. 12,90% và 87,10%.
D. 56,45% và 43,55%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 35
A. Cu, Al2O3, MgO.
B. Cu, Mg.
C. Cu, Mg, Al2O3.
D. Cu, MgO.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 37
A. 105,16.
B. 119,50.
C. 95,60.
D. 114,72.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 38
A. 19,5.
B. 15,6.
C. 3,9.
D. 7,8.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.