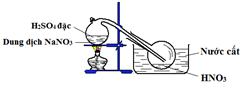
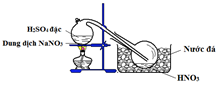
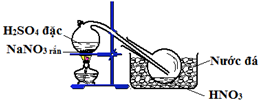
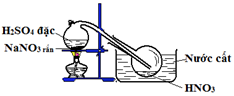
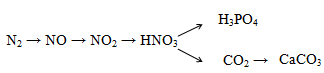
Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 29)
26 người thi tuần này 4.6 16.9 K lượt thi 26 câu hỏi 60 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi cuối kì 2 Hóa 11 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 11 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 11 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 11 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 11 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 11 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 11 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 11 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 2
Danh sách câu hỏi:
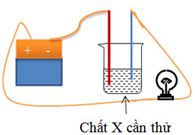
Câu 1
A. dd Ba(OH)2
B. quỳ tím
C. dd AgNO3
D. dd NaOH
Lời giải
Chọn đáp án A
Phương pháp giải:
Giải chi tiết:
Khi cho dung dịch Ba(OH)2 dư vào các dung dịch trên và đun nóng
+) Nếu ống nghiệm xuất hiện kết tủa trắng đồng thời thoát ra khí mùi khai thì đó là (NH4)2SO4
+) Nếu ống nghiệm thoát ra khí mùi khai là NH4Cl
+) Nếu ống nghiệm xuất hiện kết tủa trắng là MgCl2
+) Nếu ống nghiệm không có hiện tượng là NaNO3
PTHH: Ba(OH)2 + (NH4)2SO4 → BaSO4 ↓ + 2NH3 ↑ + 2H2O
Ba(OH)2 + 2NH4Cl → BaCl2 + NH3 ↑ + H2O
Ba(OH)2 + MgCl2 → Mg(OH)2 ↓ + BaCl2
Câu 2
A. CaCl2 nóng chảy
B. Dung dịch NaOH
C. Dung dịch Ca(OH)2
D. KCl rắn khan
Lời giải
Chọn đáp án D
Phương pháp giải:
Dung dịch điện li có thể dẫn điện.
Giải chi tiết:
Để bóng đèn sáng thì dung dịch X cần thử là dung dịch điện li
→ X không sáng khi X là KCl rắn khan là vì KCl khan không phải là chất điện li
Câu 3
A. Dung dịch NaOH vừa đủ.
B. Dung dịch KCl vừa đủ.
C. Dung dịch Na2CO3 vừa đủ.
D. Dung dịch K2SO4 vừa đủ.
Lời giải
Chọn đáp án C
Phương pháp giải:
Ion được tách khỏi dung dịch khi nó tạo thành kết tủa hoặc chất khí.
Giải chi tiết:
Dung dịch ban đầu: Na+, H+, Ba2+, Mg2+, Cl-
A. Dùng dung dịch NaOH vừa đủ thì tách được H+, Mg2+:
H+ + OH- → H2O
Mg2+ + 2OH- → Mg(OH)2 ↓
B. Dùng dung dịch KCl vừa đủ không tách được ion nào, thêm ion K+
C. Dùng dung dịch Na2CO3 vừa đủ thì tách được Ba2+, Mg2+ và H+:
Ba2+ + CO32- → BaCO3 ↓
Mg2+ + CO32- → MgCO3 ↓
2H+ + CO32- → H2O + CO2 ↑
D. Dùng dung dịch K2SO4 vừa đủ thì tách được ion Ba2+:
Ba2+ + SO42- → BaSO4 ↓
→ Dùng Na2CO3 tách được nhiều ion nhất
Câu 4
A. 5,064
B. 20,504
C. 25,412
D. 4,908
Lời giải
Chọn đáp án C
Phương pháp giải:
Các phản ứng giữa các ion:
OH- + H+ → H2O
Fe3+ + 3OH- → Fe(OH)3
Al3+ + 3OH- → Al(OH)3
→ nếu nOH- dư → Al(OH)3 hòa tan một phần
OH- + Al(OH)3 → AlO2- + 2H2O
Ba2+ +SO42- → BaSO4
Giải chi tiết:
Ta có: nBa(OH)2 = 0,125 mol → Ba2+: 0,125 mol và OH-: 0,25 mol
Dung dịch còn lại có Fe3+: 0,024 mol; Al3+: 0,032 mol; SO42-: 0,088 mol; Cl-: 0,072 mol và H+: 0,08 mol
Khi nhỏ từ từ Ba(OH)2 vào thì
OH- + H+ → H2O
0,08 ← 0,08
Fe3+ + 3OH- → Fe(OH)3
0,024 → 0,072 → 0,072
Al3+ + 3OH- → Al(OH)3
0,032 → 0,096 → 0,032
→ nOH- dư = 0,25 - 0,08 - 0,072 - 0,096 = 0,002 mol → Al(OH)3 hòa tan một phần
OH- + Al(OH)3 → AlO2- + 2H2O
0,002 → 0,002 mol
Ba2+ + SO42- → BaSO4
0,088 ← 0,088 → 0,088
→ Kết tủa tạo ra có 0,024 mol Fe(OH)3; 0,03 mol Al(OH)3 và 0,088 mol BaSO4
→ m = 25,412 gam
Câu 5
A. Nồng độ những ion nào trong dung dịch lớn nhất
B. Bản chất của phản ứng trong dung dịch các chất điện li
C. Không tồn tại phân tử trong dung dịch các chất điện li
D. Những ion nào tồn tại trong dung dịch
Lời giải
Chọn đáp án B
Phương trình rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch các chất điện li.
Câu 6
A. Điều chế hợp chất cơ photpho (làm thuốc trừ sâu)
B. H3PO4 tinh khiết dùng trong công nghiệp dược phẩm
C. Điều chế đạn cháy, đạn khói
D. Điều chế muối photphat, phân lân…
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. Phân hỗn hợp chứa nitơ, photpho, kali được gọi chung là phân NPK.
B. Phân urê có công thức là (NH4)2CO3.
C. Amophot là hỗn hợp các muối (NH4)2HPO4 và KNO3.
D. Phân lân cung cấp nitơ hóa hợp cho cây dưới dạng ion nitrat (NO3-) và ion amoni (NH4+).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
A. Ở điều kiện thường, N2 là chất khí
B. Phân tử N2 có chứa liên kết ba
C. Khí N2 tan rất tốt trong nước
D. Khí N2 không duy trì sự cháy và sự hô hấp
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
A. Tính khử và tính bazơ mạnh
B. Tính khử và tính bazơ yếu
C. Tính oxi hóa và tính bazơ mạnh
D. Tính oxi hóa và tính bazơ yếu
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
A. Một hợp chất có khả năng phân li ra cation H+ trong nước là axit
B. Một bazơ không nhất thiết phải có nhóm OH- trong phân tử
C. Một hợp chất trong thành phần phân tử có hidro là axit
D. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
A. 2,24 lít
B. 5,6 lít
C. 0,336 lít
D. 1,12 lít
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
A. Không xác định được.
B. Kiềm.
C. Trung tính.
D. Axit.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
A. NaOH, F2, O2, Ca
B. HCl, O2, Cu, Cl2
C. F2, Ne, O2, Ca
D. Cl2, C, Mg, Cu
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 19
A. 2NaOH + CuCl2 → 2NaCl + Cu(OH)2
B. HCl + AgNO3 → AgCl + HNO3
C. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
D. MgSO4 + BaCl2→ MgCl2 + BaSO4
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 20
A. 0,16M
B. 0,4M
C. 0,12M
D. 0,8M
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.