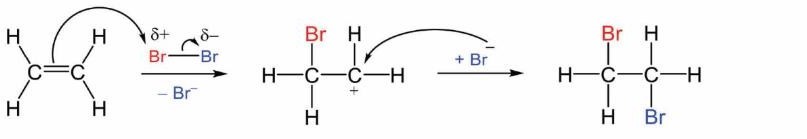
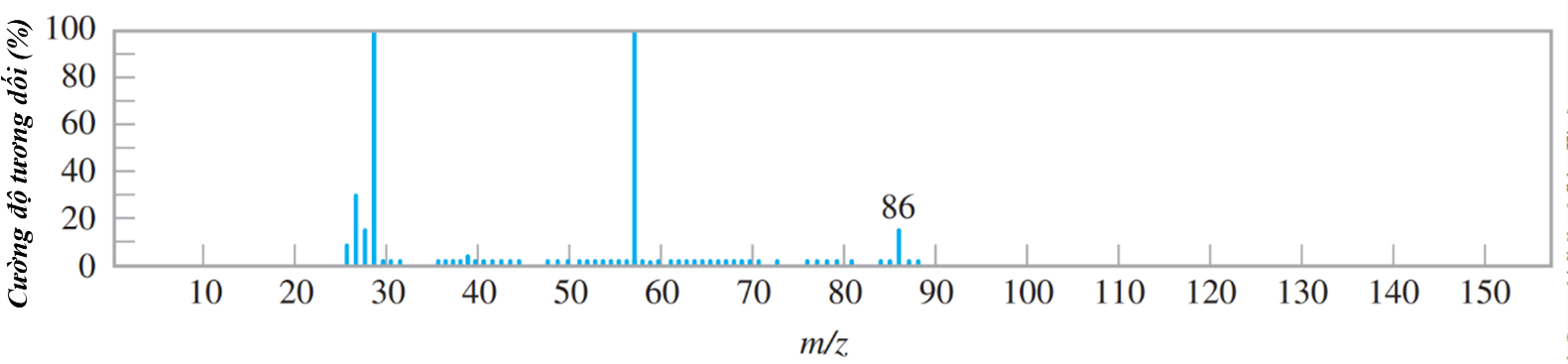
Đề thi thử tốt nghiệp THPT môn Hóa học THPT Lần 1 Sở Thái Nguyên có đáp án
92 người thi tuần này 4.6 3.2 K lượt thi 40 câu hỏi 60 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 Liên Trường Nghệ An lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Lê Quý Đôn (Nam Định) lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Chuyên Phan Bội Châu (Nghệ An) lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 Cụm 13 trường Hải Phòng lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 Sở Phú Thọ lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 cụm trường Hải Phòng lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Bạch Đằng (Hải Phòng) lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Chuyên Trần Phú (Hải Phòng) lần 1 mã đề 0111 có đáp án
Danh sách câu hỏi:
Câu 1
Lời giải
Chọn A
Câu 2
Lời giải
Chọn D
Lời giải
Chọn A
Câu 5
Lời giải
Chọn C
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
Hiện nay, khí CO2 là một trong những chất chữa cháy có thể dập tắt được nhiều loại đám cháy. Khí CO2 trong bình chữa cháy được nén ở thể lỏng và nhiệt độ thấp (−70 oC), khi phun ra sẽ làm loãng nồng độ oxygen và thu nhiệt xung quanh làm giảm nhiệt độ trong vùng cháy.
Cho các phát biểu sau:

(a) Khí CO2 được sử dụng chủ yếu trong bình chữa cháy để dập tắt các đám cháy chất lỏng, các đám cháy kim loại (Al, Mg), các đám cháy thiết bị điện, các đám cháy trong phòng thí nghiệm, các khoang tàu, hầm tàu,...
(b) Dùng bình khí CO2 chữa cháy các đám cháy than hồng có thể tạo ra khí độc hại và nguy hiểm.
(c) Do sau khi chữa cháy, khí CO2 không để lại dấu vết, không gây hư hỏng thiết bị nên bình chữa cháy bằng khí CO2 được sử dụng nhiều trong phòng thí nghiệm hóa học và dược học.
(d) Khi nồng độ khí CO2 đủ để dập tắt đám cháy trong phòng kín thì có thể gây nguy hiểm cho sức khỏe và tính mạng nếu con người còn ở trong phòng bị cháy.
Số phát biểu đúng là
Hiện nay, khí CO2 là một trong những chất chữa cháy có thể dập tắt được nhiều loại đám cháy. Khí CO2 trong bình chữa cháy được nén ở thể lỏng và nhiệt độ thấp (−70 oC), khi phun ra sẽ làm loãng nồng độ oxygen và thu nhiệt xung quanh làm giảm nhiệt độ trong vùng cháy.
Cho các phát biểu sau:

(a) Khí CO2 được sử dụng chủ yếu trong bình chữa cháy để dập tắt các đám cháy chất lỏng, các đám cháy kim loại (Al, Mg), các đám cháy thiết bị điện, các đám cháy trong phòng thí nghiệm, các khoang tàu, hầm tàu,...
(b) Dùng bình khí CO2 chữa cháy các đám cháy than hồng có thể tạo ra khí độc hại và nguy hiểm.
(c) Do sau khi chữa cháy, khí CO2 không để lại dấu vết, không gây hư hỏng thiết bị nên bình chữa cháy bằng khí CO2 được sử dụng nhiều trong phòng thí nghiệm hóa học và dược học.
(d) Khi nồng độ khí CO2 đủ để dập tắt đám cháy trong phòng kín thì có thể gây nguy hiểm cho sức khỏe và tính mạng nếu con người còn ở trong phòng bị cháy.
Số phát biểu đúng làLời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 1
Phần II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Saccharose được sử dụng như một chất làm ngọt phổ biến trong sản xuất thực phẩm, có trong nhiều loài thực vật, có nhiều nhất trong cây mía, củ cải đường và hoa thốt nốt.
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho khoảng 2 mL dung dịch NaOH 10% vào ống nghiệm. Sau đó, thêm khoảng 0,5 mL dung dịch CuSO4 5% vào, lắc nhẹ.
Bước 2: Cho khoảng 3 mL dung dịch saccharose 5% vào ống nghiệm, lắc đều, thu được dung dịch X.
Bước 3: Đun nóng dung dịch X.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 2
Tiến hành thí nghiệm (như hình vẽ): Rót dung dịch NaCl bão hoà vào cốc 1, cốc 2, cốc 3; cho dầu nhờn vào cốc 4. Cho vào cốc 1 và cốc 4 một đinh sắt sạch, cho vào cốc 2 đinh sắt sạch được quấn bởi dây kẽm, cho vào cốc 3 đinh sắt sạch được quấn bởi dây đồng. Để 4 cốc trong không khí khoảng 5 ngày.
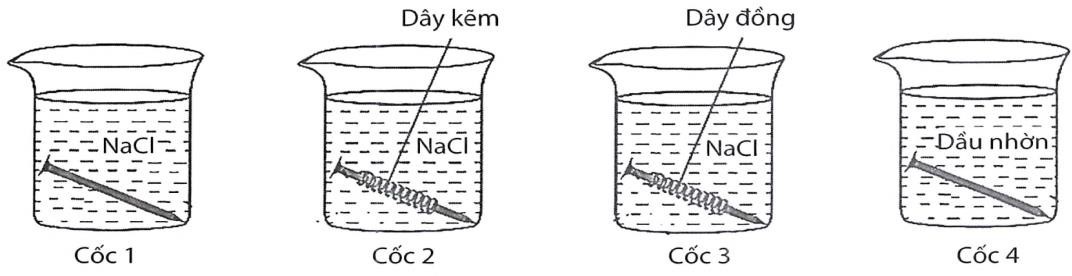
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 3
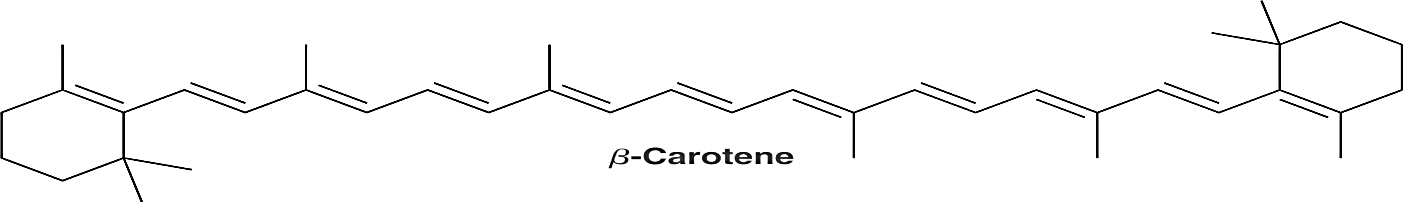
β−carotene có rất nhiều trong rau quả xanh và vàng đặc biệt là ở quả gấc, cà rốt… β−carotene được cơ thể chuyển hóa thành vitamin A rất cần thiết cho cơ thể. Công thức cấu tạo của β−carotene là
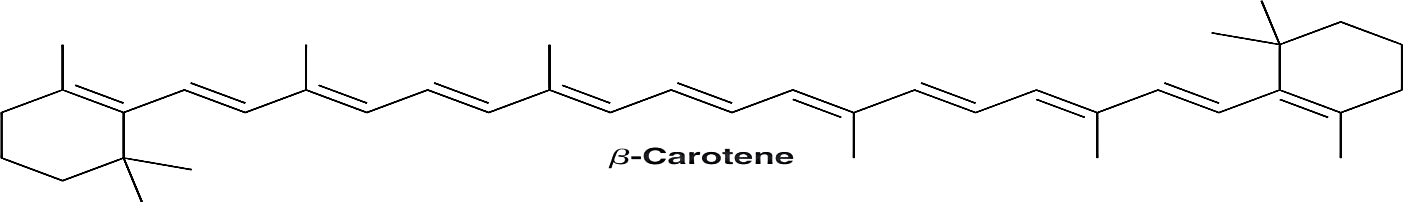
Thực hiện thí nghiệm tách β−carotene từ nước ép cà rốt như sau:
− Chuẩn bị: nước ép cà rốt, hexane; cốc thuỷ tinh 100 mL, bình tam giác 100 mL, phễu chiết 60 mL, giá thí nghiệm.
− Tiến hành:
Bước 1: Cho khoảng 20 mL nước ép cà rốt vào phễu chiết. Thêm tiếp khoảng 20 mL hexane, lắc đều khoảng 2 phút.
Bước 2: Để yên phễu chiết trên giá thí nghiệm khoảng 5 phút để chất lỏng tách thành hai lớp.
Bước 3: Mở khoá phễu chiết cho phần nước ở dưới chảy xuống, còn lại phần dung dịch β−carotene hoà tan trong hexane.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 4
Cho các bán phản ứng sau:
Zn2+ + 2e Zn ; = −0,762V; Fe2+ + 2e Fe; = −0,440V
Cu2+ + 2e Cu; = +0,340V; Fe3+ + 1e Fe2+; = +0,771V
O2 + 2H+ + 2e H2O2; = +0,695V; H2O2 + 2H+ + 2e 2H2O; = +1,770V
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.