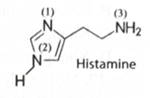
(2025 mới) Đề ôn thi tốt nghiệp THPT môn Hóa (Đề số 8)
75 người thi tuần này 4.6 4.2 K lượt thi 40 câu hỏi 60 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Đông Hưng lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Thuận Thành (Bắc Ninh) lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Hàn Thuyên (Bắc Ninh) lần 1 mã 0411 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Nguyễn Khuyến (Bình Dương) tháng 7 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Đồng Đậu (Phú Thọ) lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Chuyên Bắc Ninh lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Nguyễn Khuyến (Bình Dương) có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Nguyễn Khuyến (Hồ Chí Minh) mã đề thi 137 có đáp án
Danh sách câu hỏi:
Câu 2
Lời giải
Chọn đáp án A
Câu 3
Lời giải
Chọn đáp án B
Câu 4
Lời giải
Chọn đáp án D
Câu 5
A. 6,88 tấn.
Lời giải
Chọn đáp án A
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 9
A. bậc một.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
Vàng Au đơn chất tồn tại trong tự nhiên ở trong quặng vàng thường có hàm lượng vàng thấp. Để thu hồi vàng từ quặng vàng, người ta nghiền quặng, hoà tan chúng vào dung dịch KCN và liên tục sục không khí vào. Vàng bị hoà tan tạo thành phức chất:
và sau đó kết tủa vàng bằng kẽm Zn:
Nếu dùng 13 kg KCN thì có thể tách được bao nhiêu kg vàng từ quặng theo chuỗi phản ứng trên? Giả thiết các chất khác trong quặng không phản ứng với KCN.
Vàng Au đơn chất tồn tại trong tự nhiên ở trong quặng vàng thường có hàm lượng vàng thấp. Để thu hồi vàng từ quặng vàng, người ta nghiền quặng, hoà tan chúng vào dung dịch KCN và liên tục sục không khí vào. Vàng bị hoà tan tạo thành phức chất:
và sau đó kết tủa vàng bằng kẽm Zn:
Nếu dùng 13 kg KCN thì có thể tách được bao nhiêu kg vàng từ quặng theo chuỗi phản ứng trên? Giả thiết các chất khác trong quặng không phản ứng với KCN.
A. \(19,7\;{\rm{kg}}.\)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 1
Trong mỗi ý a, b, c, dở mỗi câu, thí sinh chọn đúng hoặc sai.
Phân tích nguyên tố hợp chất hữu cơ E cho kết quả phần trăm khối lượng carbon, hydrogen và oxygen lần lượt là 54,55 % ; 9,09 % và 36,36 %. Dựa vào phương pháp phân tích khối phổ (MS) xác định được phân tử khối của E là 88. Mặt khác, phổ hồng ngoại (IR) cho thấy phân tử E không chứa nhóm -OH (peak có số sóng \( > 3000\;{\rm{c}}{{\rm{m}}^{ - 1}}\)) nhưng lại chứa nhóm \({\rm{C}} = {\rm{O}}\left( {1780\;{\rm{c}}{{\rm{m}}^{ - 1}}} \right).\)
Thuỷ phân hoàn toàn E trong dung dịch NaOH, thu được muối của carboxylic acid X và chất Y. Chất Y có nhiệt độ sôi \(\left( {64,{7^o }{\rm{C}}} \right)\) nhỏ hơn nhiệt độ sôi của ethanol \(\left( {78,{3^o }{\rm{C}}} \right)\) (nhiệt độ sôi đều đo ở áp suất 1 atm).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 2
Poly(ethylene terephthalate) (viết tắt là PET) được điều chế theo sơ đồ phản ứng sau:
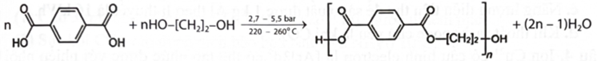
PET có mã số kí hiệu trên sản phẩm là số 1 và thuộc loại polymer nhiệt dẻo phổ biến nhất, có thể tái chế và được sử dụng để dệt sợi may quần áo, thảm, đồ hộp đựng chất lỏng và thực phẩm, ...
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 3
\({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) có nhiệt độ nóng chảy rất cao \(\left( {{{2050}^o }{\rm{C}}} \right)\) nên việc điện phân nóng chảy \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) nguyên chất sẽ khó thực hiện. Hiện nay, theo công nghệ Hall-Héroult, người ta hoà tan \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) trong cryolite \(\left( {{\rm{N}}{{\rm{a}}_3}{\rm{Al}}{{\rm{F}}_6}} \right)\) nóng chảy được hỗn hợp chất điện phân có nhiệt độ nóng chảy thấp hơn (khoảng gần \({1000^o }{\rm{C}}\)). Giải pháp này giúp tiết kiệm năng lượng, đồng thời tạo ra chất lỏng có tính dẫn điện tốt, nhẹ hơn Al và nổi lên phía trên lớp Al lỏng, bảo vệ Al không bị oxi hoá bởi không khí. Sơ đồ thùng điện phân được biểu diễn như hình dưới:
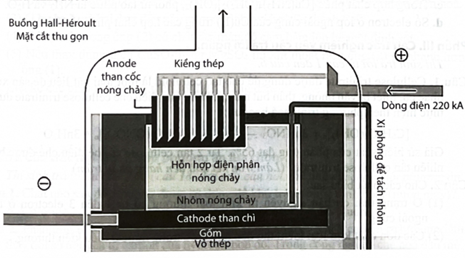
Quá trình điện phân được tiến hành với dòng điện có hiệu điện thế thấp (khoảng 5 V) và cường độ dòng điện \(100 - 300{\rm{kA}}.\) Để sản xuất được 1 tấn Al cần tiêu tốn khoảng 2 tấn \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3},50\;{\rm{kg}}\) cryolite, 400 kg than cốc.
Cho biết: Năng lượng điện tiêu thụ theo lí thuyết, \({{\rm{A}}_{{\rm{lt}}}} = \frac{{{\rm{U}} \cdot {{\rm{m}}_{{\rm{Al}}}} \cdot {{\rm{F}}_{9 \times 3,6 \cdot {{10}^6}}}}}{{({\rm{kWh}})}}.\) Với: \({{\rm{m}}_{{\rm{Al}}}}\) là khối lượng Al được điều chế (gam); F là hằng số Faraday, \({\rm{F}} = 96485{\rm{Cmo}}{{\rm{l}}^{ - 1}};{\rm{U}}({\rm{V}})\) là hiệu điện thế áp đặt vào hai cực của bình điện phân.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 4
Ion \({\rm{C}}{{\rm{u}}^{2 + }}\) có cấu hình electron là \([{\rm{Ar}}]3\;{{\rm{d}}^9}\) có thể tạo phức được với nhiều phối tử bằng liên kết cho nhận giữa phối tử với các orbital trống của ion \({\rm{C}}{{\rm{u}}^{2 + }}.\) Một thí nghiệm về sự tạo thành hợp chất phức được thực hiện như sau:
Hoà tan hoàn toàn một lượng muối \({\rm{CuS}}{{\rm{O}}_4}\) khan (màu trắng) vào nước, thu được dung dịch X có màu xanh.
Thêm tiếp dung dịch \({\rm{N}}{{\rm{H}}_3}\) vào dung dịch X, thu được kết tủa màu xanh nhạt.
Tiếp tục thêm dung dịch \({\rm{N}}{{\rm{H}}_3}\) đặc đến dư vào đến khi kết tủa bị hoà tan, thu được dung dịch Y có màu xanh lam. Chuỗi thí nghiệm trên được biểu diễn qua sơ đồ sau:
Màu xanh của kết tủa và dung dịch được lí giải là do sự hình thành các ion phức trong hợp chất phức gây ra.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.