230 Bài tập thí nghiệm Hóa Học cực hay có đáp án(Đề số 7)
28 người thi tuần này 4.6 14 K lượt thi 32 câu hỏi 50 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 Liên Trường Nghệ An lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Lê Quý Đôn (Nam Định) lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Chuyên Phan Bội Châu (Nghệ An) lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 Cụm 13 trường Hải Phòng lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 Sở Phú Thọ lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 cụm trường Hải Phòng lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Bạch Đằng (Hải Phòng) lần 1 có đáp án
Đề thi thử Tốt nghiệp THPT Hóa học 2025 - 2026 trường THPT Chuyên Trần Phú (Hải Phòng) lần 1 mã đề 0111 có đáp án
Danh sách câu hỏi:
Câu 1
Tiến hành thi nghiệm với các chất X, Y, z, T. Kết quả được ghi ở bảng sau:
|
Mẫu thử |
Thí nghiệm |
Hiện tượng |
|
X |
Tác dụng với Cu(OH)2 |
Hợp chất có màu tím |
|
Y |
Quỳ tím ẩm |
Quỳ đổi màu xanh |
|
Z |
Tác dụng với dung dịch Br2 |
Dung dịch mất màu và tạo kết tủa trắng |
|
T |
Tác dụng với dung dịch Br2 |
Dung dịch mất màu |
Các chất X, Y, Z, T lần lượt là
A. acrilonitrin, anilin, Gly-Ala-Ala, metylamin.
B. Metylamin, anilin, Gly-Ala-Ala, acrilonitrin.
C. Gly-Ala-Ala, metylamin, acrilonitrin, anilin.
D. Gly-Ala-Ala, metylamin, anilin, acrilonitrin.
Lời giải
Để ý rằng Z phản ứng Br2 tạo kết tủa trắng, trong các đáp án chỉ có anilin
=> Chọn đáp án D.
Câu 2
A. Y < X < M < Z.
B. Z < Y < X < M.
C.M<Z<X<Y.
D. Y < X < Z < M.
Lời giải
Xét từng thí nghiệm:
- Từ thí nghiệm 1, có khí thoát ra, chứng tỏ kim loại đó có tác dụng với H2OM là kim loại kiềm hoặc kiềm thổ.
- Từ thí nghiệm 2 tính khử của Y < X nên X đẩy được Y ra khỏi muối của nó.
- Từ thí nghiệm 3 tính khử của X < Z
- Từ thí nghiệm 4 tính khử của Z < M
Vậy thứ tự tính khử của các kim loại theo thứ tự tăng dần: Y < X < Z < M.
Chọn đáp án D.
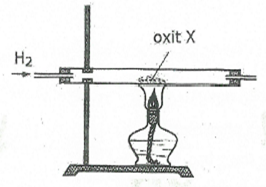
Câu 3
A. K2O
B. Al2O3
C. CuO
D. MgO
Lời giải
Oxit X phải là oxit của kim loại đứng sau Al trong dãy điện hoá
=>Chọn đáp án C.
Câu 4
A. Không có phản ứng xảy ra.
B. Phản ứng dễ hơn benzen, ưu tiên vị trí meta.
C. Phản ứng khó hơn benzen, ưu tiên vị trí meta.
D. Phản ứng khó hơn benzen, ưu tiên vị trí ortho.
Lời giải
Nitrobenzen có chứa nhóm thế NO2 là nhóm hút e
=> Làm mật độ e trên vòng giảm.
=> Khả năng tham gia phản ứng thế khó khăn và ưu tiên vào vị trí meta.
=> Chọn đáp án C.
Lời giải
Các phản ứng:
![]()
![]()
![]()
(3) Mg + 2FeCl3 dư MgCl2 + 2FeCl2.
(4) Cu + 2FeCl3 CuCl2 + 2FeCl2.
=> Chọn đáp án B.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. Z, T làm xanh quỳ tím ẩm.
B. Dung dịch X có tính axit; dung dịch Y, Z, T có tính bazơ.
C. X, Y tạo kết tủa trắng với nước brom.
D. Phân biệt dung dịch X với dung dịch Y bằng quỳ tím.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
A. Glucozơ, anilin, phenol, fructozơ.
B. Anilin, fructozơ, phenol, glucozơ.
C. Phenol, fructozơ, anilin, glucozơ.
D. Fructozơ, phenol, glucozơ, anilin.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
A. Chỉ cách 1
B. Chỉ cách 2
C. Chỉ cách 3
D. Cách 2 hoặc Cách 3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
A. Cho kim loại Fe vào dung dịch Fe2(SO4)3.
B. Cho kim loại Mg vào dung dịch HNO3.
C. Cho kim loại Zn vào dung dịch CuSO4.
D. Cho kim loại Ag vào dung dịch HCl.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
A. Axit axetic và ancol isoamylic (xt H2SO4 loãng).
B. Axit axetic và ancol isoamylic (xt H2SO4 đặc).
C. Giấm ăn và ancol isoamylic (xt H2SO4 loãng).
D. Natri axetat và ancol isoamylic (xt H2SO4 loãng).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 19
A. NH4C1 + NaOH NaCl + NH3 + H2O
B. C2H5OH C2H4 + H2O
C. NaCl (rắn) + H2SO4 (đặc) NaHSO4 + HCl
D. CH3COONa (rắn) + NaOH(rắn) Na2CO3 + CH4
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 20
A. Cho kim loại Fe vào dung dịch HCl (t°).
B. Cho Cr(OH)3 vào dung dịch KOH loãng.
C. Cho Zn vào dung dịch Cn(SO4)3.
D. Cho Fe vào dung dịch HNO3 đặc, nguội.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 21
A. Cho X vào bình chứa một lượng dư khí O3 (ở điều kiện thường).
B. Cho X vào một lượng dư dung dịch HNO3 (đặc).
C. Cho X vào một lượng dư dung dịch HCl (không có mặt O2).
D. Cho X vào một lượng dư dung dịch FeCl3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 23
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 24
A. Dung dịch Z phản ứng được với etylamin.
B. Dung dịch X chứa hợp chất không bị nhiệt phân.
C. Dung dịch T làm xanh quỳ tím.
D. Dung dịch Y phản ứng được với dung dịch NH4NO3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 25
A. Đo nhiệt độ của ngọn lửa.
B. Đo nhiệt độ của nước sôi.
C. Đo nhiệt độ sôi của chất đang chưng cất.
D. Đo nhiệt độ sôi của hỗn hợp chất trong cầu
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 29
A. X là dung dịch NaNO3.
B. T là dung dịch (NH4)2CO3.
C. Y là dung dịch KHCO3.
D. Z là dung dịch NH4NO3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
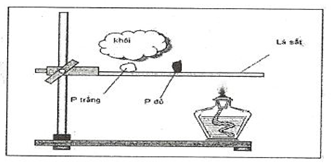
Câu 30
A. Khả năng bốc cháy của P trắng dễ hơn P đỏ.
B. Khả năng bay hơi của P trắng dễ hơn P đỏ.
C. Khả năng bốc cháy của P đỏ dễ hơn P trắng.
D. Khả năng bay hơi của P đỏ dễ hơn P trắn
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 32
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với các thuốc thử được ghi ở bảng sau:
|
Chất |
Thuốc thử |
Hiện tượng |
|
X |
Cu(OH)2 trong môi trường kiềm |
Có màu tím |
|
Y |
Đun nóng vói dung dịch NaOH dư, sau đó làm nguội, cho tiếp vài giọt dung dịch CuSO4 |
Xuất hiện màu xanh lam |
|
Z |
Nước Br2 |
Kết tủa trắng |
|
T |
Dung dịch AgNO3 trong NH3, đun nóng |
Kết tủa Ag trắng sáng |
Dung dịch X, Y, Z, T lần lượt là
A. lòng trắng trứng, triolein, anilin, glucozơ.
B. lòng trắng trứng, anilin, triolein, glucozơ.
C. triolein, lòng trắng trứng, glucozơ, anilin.
D. lòng trắng trứng, glucozơ, anilin, triolein.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.